10月11日,吉林省食品药品监督管理局发布了《关于发布药品医疗器械产品注册收费标准及实施细则》的公告,公告表示,该局制定了《吉林省药品再注册及不改变药品内在质量的补充申请注册收费实施细则》和《吉林省第二类医疗器械产品注册收费实施细则》,公布了该省药品注册与医疗器械产品注册收费标准。
《细则》明确指出,吉林省对第二类医疗器械的首次注册收费72300元,变更注册收费30300元,延续注册收费30000元。
其中,按医疗器械管理的体外诊断试剂的注册收费也应用于《实施细则》。《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于注册登记事项变更申请的,不收取变更注册费。
对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的小微企业申请创新医疗器械产品注册的,免收首次注册费。以上规定自2016年11月1日起施行。
附 吉林省食品药品监督管理局关于发布药品医疗器械产品注册收费标准及实施细则的公告
根据吉林省物价局、吉林省财政厅《关于核定药品及医疗器械产品注册费收费标准的复函》(吉省价收﹝2016﹞121号),吉林省食品药品监督管理局制定了《吉林省药品再注册及不改变药品内在质量的补充申请注册收费实施细则》和《吉林省第二类医疗器械产品注册收费实施细则》,现予公布,自2016年11月1日起施行。
特此公告。
附件:1. 吉林省物价局、吉林省财政厅《关于核定药品及医疗器械产品注册费收费标准的复函》
2. 吉林省药品再注册及不改变药品内在质量的补充申请注册收费实施细则
3. 吉林省第二类医疗器械产品注册收费实施细则
吉林省食品药品监督管理局
2016年10月11日
附件:
吉林省药品医疗器械注册收费标准。pdf
吉林省第二类医疗器械产品注册收费实施细则(试行)
依据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《关于发布药品、医疗器械产品注册收费标准的公告》(总局2015年第53号)以及《吉林省物价局 吉林省财政厅关于核定药品及医疗器械产品注册费收费标准的复函》(吉省价收〔2016〕121号)等有关规定,制定本实施细则。
一、吉林省境内第二类医疗器械产品注册收费标准
吉林省食品药品监督管理部门依照法定职责,对境内第二类医疗器械产品首次注册、变更注册、延续注册申请开展行政受理、注册质量管理体系核查,技术审评等注册工作,并按标准收取有关费用。具体标准如下:
二、注册费缴费程序
(一)注册申请人向吉林省食品药品监督管理局行政审批办公室申报境内第二类医疗器械产品首次注册申请、变更许可事项注册申请、延续注册申请,并提交申请资料。
(二)注册申请材料经审查属于本省医疗器械注册受理范围,且申报资料齐全、符合形式审查要求的,由吉林省食品药品监督管理局行政审批办公室受理,并出具《行政许可项目缴费通知书》。
(三)注册申请人应当在收到《行政许可项目缴费通知书》后,及时按要求缴费。
三、注册费缴费说明
(一)医疗器械产品注册收费按《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》确定的注册单元计收。
(二)按医疗器械管理的体外诊断试剂的注册收费适用本实施细则。
(三)《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于注册登记事项变更申请的,不收取变更注册费。
(四)吉林省食品药品监督管理部门依法做出不予许可决定的,已缴纳的注册费不予退回。
四、小微企业优惠政策
(一)优惠范围。对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的小微企业申请创新医疗器械产品注册的,免收首次注册费。
创新医疗器械产品是指国家食品药品监督管理总局创新医疗器械审查办公室依据国家食品药品监督管理总局《创新医疗器械特别审批程序(试行)》(食药监械管[2014]13号),对受理的创新医疗器械特别审批申请,组织有关专家审查并在政府网站上按规定时间公示无异议后,同意进入特别审批程序的产品。
(二)申报材料。小微企业申请收费优惠政策时,申请人应当向省食品药品监督管理局行政审批办公室提交下列材料:
1.《小型微型企业收费优惠申请表》;
2.企业的工商营业执照副本;
3.上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具);
4.由国家食品药品监督管理总局医疗器械技术审评中心出具的《创新医疗器械特别审批申请审查通知单》。
五、退费管理
(一)对于符合下列条件的注册申请人,应当予以退费。
1.因注册申请人原因错汇;
2.对于注册申请人按照第二类医疗器械产品申请首次注册或延续注册,经审评审批确认为第一类、第三类医疗器械产品。
3.其他根据相关规定予以退费的条件。
(二)退费申请。注册申请人申请办理退费手续的,应按财政厅有关要求填写申请表,并向省食品药品监督管理局行政审批办提交下述材料:
1.《吉林省非税收入退付审批表》;
2.《非税收入一般缴款书》原件;
3.汇款凭据。
(三)对于符合退费条件的,吉林省食品药品监督管理局将依据省财政厅有关规定办理退费手续。
六、自本《实施细则》发布之日起,全省新受理的第二类医疗器械产品注册收费按本规定执行。
附件:1.小型微型企业收费优惠申请表
2.吉林省非税收入退付审批表
吉林省药品再注册及不改变药品内在质量的补充申请注册收费实施细则(试行)
依据《药品注册管理办法》(国家食品药品监督管理局令第28号)、《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)、《吉林省物价局 吉林省财政厅关于核定药品及医疗器械产品注册收费标准的复函》(吉省价收〔2016〕121号)等有关规定,制定本细则。
一、药品注册收费标准
吉林省食品药品监督管理部门依照法定职责,对国产药品再注册申请和不改变药品内在质量的国产药品补充申请中开展行政受理、审查及有关的现场核查、技术审评等注册工作,并按标准收取有关费用。具体标准如下:
二、药品注册费缴费程序
(一)药品再注册申请。注册申请人向吉林省食品药品监督管理局提出药品再注册申请,吉林省食品药品监督管理局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
(二)不改变药品内在质量的补充申请。注册申请人向吉林省食品药品监督管理局提出不改变药品内在质量的补充申请,吉林省食品药品监督管理局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
三、药品注册费缴费说明
(一)药品补充申请(常规项),包括《药品注册管理办法》附件4药品补充申请注册事项第19(改变国内药品生产企业名称)、29(不需技术审评)项。
(二)药品补充申请(需技术审评),包括《药品注册管理办法》附件4药品补充申请注册事项第20(国内药品生产企业内部改变药品生产场地)、21(变更直接接触药品的包装材料或者容器)、22(改变国内生产药品的有效期)、29(需技术审评)项。
(三)《药品注册管理办法》中属于省级食品药品监督管理部门备案的药品补充申请事项,不收取补充申请注册费,如此类申请经审核认为申请内容需要技术审评的,申请人应按照需要技术审评的补充申请的收费标准补交费用。
(四)注册申请人应当在收到《行政许可项目缴费通知书》后5个工作日内按照要求缴纳注册费,未按要求缴纳的,其注册程序自行中止。
(五)注册申请受理后,申请人主动提出撤回注册申请的,或吉林省食品药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
(六)药品注册收费按每个原料药或制剂注册申请受理号计收。
(七)注册收费采取一次性收取、直接缴库方式,不重复收费。
吉林省食品药品监督管理局
2016年10月10日
医谷链
《内蒙古药监局医疗器械注册收费标准出炉:II类器械首次收费72100元目前最低》
来源:关于我们
为你推荐
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
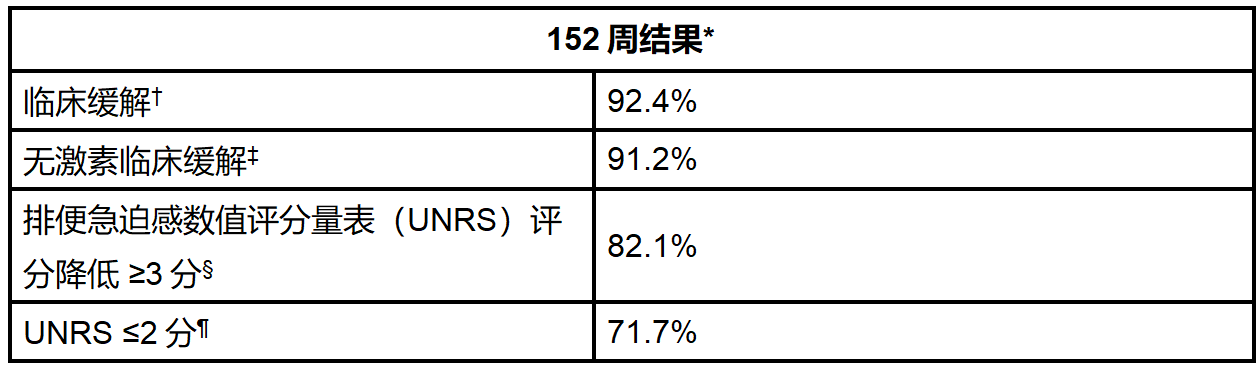
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
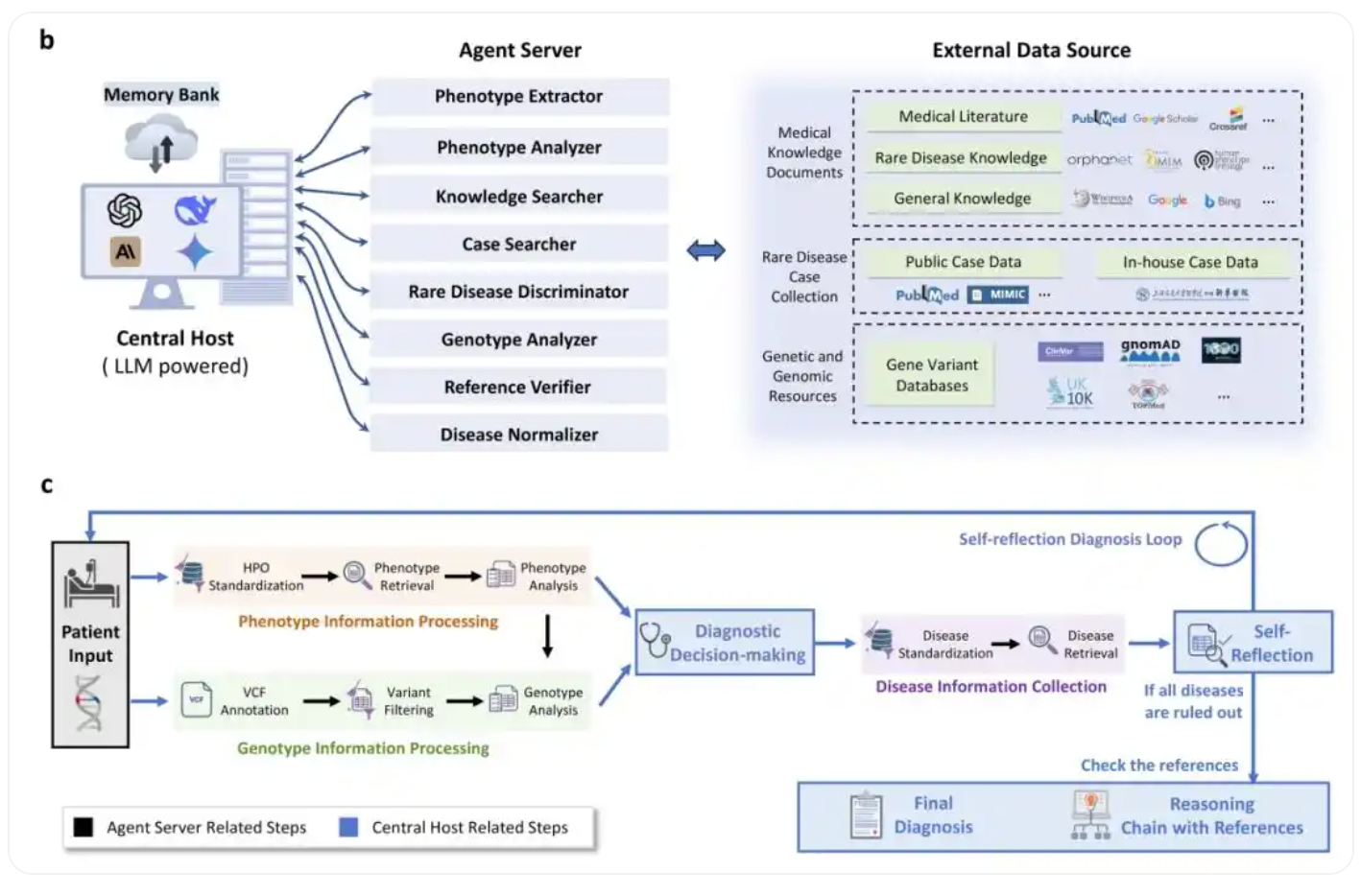
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42













