11月24日,云顶新耀宣布耐赋康(Nefecon)的新药上市许可申请(NDA)获得国家药监局批准,用于治疗具有进展风险的原发性IgA肾病成人患者。此前,耐赋康已于2021年12月和2022年7月分别获得美国FDA加速批准上市和欧盟委员会的附条件上市许可批准。自此,耐赋康也成为了继氟环素类抗菌药物依拉环素(商品名:依嘉)后,云顶新耀第二个成功实现获批的产品。
国内IgA肾病存在巨大的未满足医疗需求
中国是全球原发性肾小球疾病发病率最高的国家,而作为常见的原发性肾小球疾病,IgA肾病约占35%~50%,有约500万患者,且发病年龄较轻、预后不佳,易进展至终末期肾病。有研究显示,几乎所有IgA肾病患者在其预期寿命内均有进展为终末期肾病的风险,需要进行透析或肾移植。同时IgA肾病具有地区、种族差异,尤其是中国IgA肾病人群病理改变更严重、疾病进展速度更快。而目前国内针对IgA肾病的治疗方案以RAS抑制剂的支持性治疗和全身免疫抑制剂为主,缺少从疾病源头改变疾病进展的针对性治疗方法,即对因治疗,IgA肾病患者的治疗现状存在巨大的未满足医疗需求,而耐赋康得出现则改变了这种治疗困局。
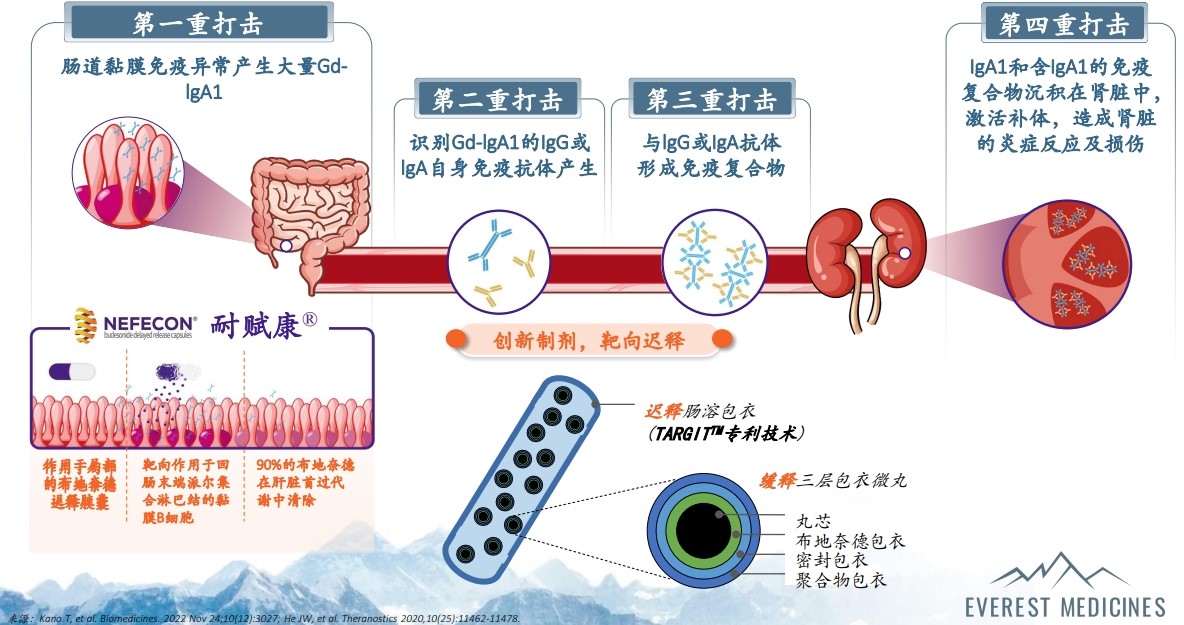
据医谷在日前举行的云顶新耀媒体沟通会上了解到,从药物机制上看,耐赋康是一款口服靶向布地奈德肠溶胶囊(布地奈德是一种具有强糖皮质激素活性和弱盐皮质激素活性的糖皮质激素,首过代谢程度达90%,具有良好的安全性),通过特殊的制作工艺,将布地奈德靶向释放于回肠末端的黏膜B细胞(包括派尔集合淋巴结),从而减少诱发IgA肾病的半乳糖缺陷的IgA1抗体(Gd-IgA1)产生,进而干预发病机制上游阶段,能减少50%肾功能下降,由此预估延缓疾病进展至透析或肾移植的时间超过10年。
一项名为NefIgArd的3期全球临床试验在接受优化RAS抑制剂治疗的原发性IgA肾病成人患者中评估了耐赋康(16mg/d,每日一次)与安慰剂相比的疗效和安全性,该项研究为期2年,包括9个月的耐赋康或安慰剂治疗期,随后是15个月的停药随访期。全球研究结果显示:与安慰剂相比,耐赋康不仅带来了持久的蛋白尿下降,减少镜下血尿风险,更重要的是在估算肾小球滤过率(eGFR)上显示出具有临床意义且统计学显着性优势(p<0.0001),能延缓肾功能衰退达50%。
值得一提的是,中国亚组数据则显示了耐赋康在肾功能保护、蛋白尿下降和镜下血尿改善等方面比全球研究中数值上更好的疗效,同时亦观察到在仅使用支持性治疗的中国患者对照组更快速的疾病进展。在2年的治疗和观察期间,耐赋康治疗组时间加权的eGFR平均下降3.7 ml/min/1.73㎡,而安慰剂组时间加权的eGFR平均下降13.3 ml/min/1.73㎡,耐赋康治疗可带来9.6 ml/min/1.73㎡的eGFR获益,这一数值大于全球人群的治疗获益(5.1 ml/min/1.73㎡)。中国人群中eGFR在24个月时较基线的平均绝对变化表明,耐赋康治疗的患者肾功能恶化程度较安慰剂减少了约66%,这一数值在全球人群约为50%。
同时,在2年内观察到耐赋康组的蛋白尿降低作用持久,与安慰剂相比,中国人群9个月的耐赋康治疗在9个月和24个月时分别使尿蛋白肌酐比值(UPCR)降低31%和43%。而全球人群在9个月与24个月时约下降30%。此外,在安慰剂组,中国人群在24个月时的平均UPCR自基线上升了18.6%,而全球人群却有轻微的下降,说明了中国人群的疾病进展相较于全球人群更快。在中国人群中,耐赋康组2年内无镜下血尿的患者比例从基线的26.9%明显改善至57.7%,而安慰剂组无变化,该中国患者数据已发表于2023年11月举行的美国肾脏病学会肾脏周。
在媒体沟通会上,云顶新耀首席执行官罗永庆对包括医谷在内的媒体表示:”耐赋康在国内的上市具有里程碑式的意义,对患者而言,耐赋康作为全球首个获批的对因治疗IgA肾病的药物,填补了从疾病源头治疗IgA肾病的空白,开启了IgA肾病治疗新时代,尤其是对于发病率更高、发病年龄更轻、疾病进展更快的中国IgA肾病患者,其可以减少肾功能衰退达66%,预计可延缓12.8年进展至肾功能衰竭,在此之前,尚未有任何一个肾病药物能取得如此大的临床获益。从公司层面看,耐赋康是云顶新耀今年短短一年内第二个成功获批的产品,其将与依嘉一起共同助力公司进入一个更加稳健发展的阶段,最终实现从Biotech转型为一家综合性的生物制药公司。”
罗永庆还披露,目前,云顶新耀正在积极筹备耐赋康的商业化上市,包括组建200人规模的商业化团队,预计将分别于今年12月和明年的第一季度分别在中国澳门(已于今年10月在澳门获批上市)和大陆正式开售,预期将覆盖600家肾病专科医院。有金融机构预估,耐赋康未来的销售峰值有望达到40亿元-50亿元的规模。
另据医谷获悉,早在今年4月,耐赋康就已在海南博鳌开展了早期准入计划(EAP)项目,并有700多名患者参与,由于前期咨询患者较多,云顶新耀将携手中国初级卫生保健基金会开展2期患者援助项目,现阶段,登记的患者数量已经超过了5000名。目前,在EAP项目中,除开基金会的补贴,一瓶(规格:120粒)耐赋康的售价为18600元,为期9个月的一个疗程自负费用接近17万元。
谈及如何提升耐赋康的可及性,罗永庆表示:“未来,耐赋康将积极参与国家医保谈判,以进入国家医保目录来降低病人的经济负担,在此之前,会通过患者援助计划、商业保险计划等多元化的方式来扩大可及性,以期希望在追求最大程度地满足临床需求的同时,在企业、患者、支付体系之间达成良性的、可持续的平衡。”
“License in+自研”模式已初见成效
在新药研发的道路上,主要分为三种模式,分别为自主研发、License-in,以及VIC(VC(风险投资)+IP(知识产权)+CRO(研发外包)相结合)模式,其中,自主研发是最为难走的道路,这需要药企具备相当雄厚的研发实力、资金财力、以及耐力,而与之相对应的License-in看似更为“讨巧”和便捷,云顶新耀就选取了一条“License-in+自研”的双驱动模式立足,但在现有管线中,大部分产品均来自License-in,业内不是没有质疑过云顶新耀这种以License-in为主流的模式是否经得住考验。
从一家药企长远发展的眼光来看,License in会是一个好模式吗?对此,有业内人士认为,答案是肯定的,究其原因,是当下的中国医药产业正处于风云激荡的时代,大量的创新药项目正在陆续开展,资本堆起来的license in能够对目前创新能力不足、研发扎堆的大环境带来新的活力。同时,License in模式能够相对快速的推进其研发进度,引进国外的优质品种,与国内盛行的me too类项目同台竞技,有利于整体新药质量的提升和标准的建立。
在罗永庆看来,则将License in业务模式称为是一条“务实的道路”,“该模式让我们得以规避前期的临床失败风险,并专注于已或相当接近获得监管批准及商业化,且极有可能成功的产品,既做到了研发的自主性和前瞻性,又保证了公司发展的平稳性,且减少了对外部融资的依赖,目前公司两款产品的成功获批也证明了该模式的初步成效。当然,这样的策略并不适用于所有Biotech公司,强大的研发能力和BD团队以及新锐的眼光依然是必不可少的。”他说道。
而对于从Biotech进阶到Biopharma后的规划,罗永庆表示:“第一,我们需要证明公司的商业化能力,让公司获批的药物能够惠及更多的患者;第二,增强自身的自研能力,公司依然有很多管线处于研发之中,会加大加码自主研发;第三,保证稳健的财务状况,随着商业化的推进,会不断有现金流涌入,追求商业化效率会是一个永恒的话题;第四,改变企业文化,公司未来将尽可能地将研发和商业化完美地融合在一起。”
据医谷了解,在云顶新耀的License in管线中,除了已获批上市的依嘉和耐赋康,用于治疗肾小球疾病的候选产品布鲁顿酪氨酸激酶(BTK)抑制剂EVER001已进展至临床1b期试验阶段;用于治疗狼疮性肾炎的zetomipzomib的临床试验正在推进中;用于治疗成人复杂性尿路感染的头孢吡肟/他尼硼巴坦将于近期向国家药监局提交新药上市申请,这也意味着在不久的将来,云顶新耀又将迎来一个收获期。
来源:医谷网 作者:史士云
为你推荐
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
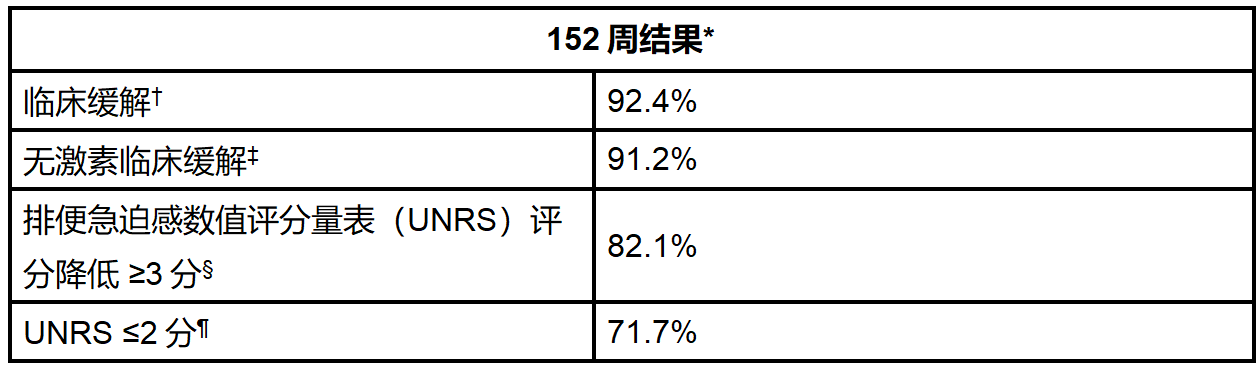
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58