已报告阳性结果的PACIFIC III期临床试验更新的随访结果显示,阿斯利康的英飞凡(化学名:度伐利尤单抗Durvalumab,商品名:英飞凡Imfinzi)在接受了同步放化疗(CRT)后未出现疾病进展的III期不可切除的非小细胞肺癌(NSCLC)患者中,在五年时显示出了持续且具有临床意义的总生存期(OS)和无疾病进展生存期(PFS)获益。
肺癌是致使癌症患者死亡的主要原因,约占所有癌症患者死亡的五分之一。在所有肺癌患者中,80-85%为非小细胞肺癌1-3,四分之一的非小细胞肺癌患者在确诊时已处于III期,且大多数肿瘤不可切除(无法通过手术清除)4,5。基于此项临床试验的结果,度伐利尤单抗的获批成为数十年来这些患者可获得的的首个新疗法2,6,7。
最新的事后性分析结果显示,放化疗之后,度伐利尤单抗治疗组的五年总生存率为42.9%,而安慰剂组的为33.4%。度伐利尤单抗组和安慰剂组的中位总生存期(OS)分别为47.5个月和29.1个月。在疗程最长为一年的治疗后,接受度伐利尤单抗治疗的III期不可切除的非小细胞肺癌患者中, 33.1%的患者在入组五年后仍未出现疾病进展,而安慰剂组为19%。继2017年和2018年分别在《新英格兰医学杂志》(NEJM)公布主要的PFS和OS分析数据后,此次更新的数据进一步印证了度伐利尤单抗在这些主要研究终点方面所带来的持续显著获益。8,9
Sarah Cannon 研究所首席科学官、 PACIFIC 临床试验研究者 David Spigel 博士表示:“这项试验再次开创了III 期不可切除非小细胞肺癌患者治疗先河。以往,这些患者中仅有 15-30% 能存活五年。但上述研究结果表明,使用度伐利尤单抗最长治疗一年后,有 43% 的患者在五年时仍然存活。而且,这些患者中有四分之三在第五年时未出现疾病进展。这是以治愈为目的的治疗领域中,在五年里程碑时间点上取得的重大成就。”
阿斯利康肿瘤业务部执行副总裁Dave Fredrickson表示:“对于癌症患者及其家人来说,五年生存期是一个具有临床和情感意义的里程碑。我们欣喜地看到,大多数患者在完成治疗四年后仍未出现疾病进展。此次公布的针对III期不可切除肺癌患者的长期获益数据,强力证实了在以治愈为目的的治疗领域,度伐利尤单抗已成为标准治疗。基于 PACIFIC等临床试验以及我们针对各类早期癌症的综合性开发项目,我们的策略是通过尽早开展治疗,帮助患者改善癌症结局,旨在提供改变生命的疗法,增加治愈的可能性。”
III期PACIFIC试验的总生存期(OS)的主要分析发现,度伐利尤单抗组和安慰剂组中,最常见的不良反应(发生率大于或等于20%)包括:咳嗽(35.2% vs. 25.2%),疲劳(24.0% vs. 20.5%),呼吸困难(22.3% vs. 23.9%), 以及放射性肺炎(20.2% vs. 15.8%)。度伐利尤单抗治疗的患者中有30.5%出现了3级或4级不良反应,而安慰剂组为26.1%;度伐利尤单抗组中15.4%的患者因不良反应而终止治疗, 而安慰剂组中的比例为9.8%。9这些数据已于6月4日在美国临床肿瘤学会(ASCO)年会上对外发布。
度伐利尤单抗已在美国、日本、中国、欧盟和其它多个国家获批用于以根治为目的的放化疗后Ⅲ期不可切除非小细胞肺癌治疗,自 2018 年 2 月首次获批以来,已有超过 80,000 名患者接受了度伐利尤单抗治疗。
阿斯利康正在进行多项使用度伐利尤单抗治疗更早期肺癌的注册性临床试验,包括具有潜在治愈可能的研究(PACIFIC-2, PACIFIC-4, PACIFIC-5, MERMAID-1, MERMAID-2, AEGEAN, ADJUVANT BR.31和 ADRIATIC等III期临床试验)。阿斯利康还在进行针对III期不可切除非小细胞肺癌(COAST)和早期新辅助治疗(NeoCOAST)的两项II期平台型临床试验,测试基于度伐利尤单抗的创新组合疗法。
关于III期非小细胞肺癌
2020 年,全球大约有 220 万人被诊断出患有肺癌1。肺癌大致可分为非小细胞肺癌和小细胞肺癌,其中 80-85% 被归类为非小细胞肺癌2,3,5。III 期非小细胞肺癌约占非小细胞肺癌病例总数的四分之一 4。
根据癌细胞的局部扩散范围,III期(局部晚期)非小细胞肺癌可分为三个亚类(IIIA、IIIB 和 IIIC)。与癌细胞已经扩散(转移) 的IV 期不同,大多数 III 期患者目前正在接受以治愈为目的的治疗。5,10
关于PACIFIC研究
PACIFIC是一项随机、双盲、安慰剂对照的国际多中心III期临床试验,使用度伐利尤单抗治疗接受了以铂类为基础的同步放化疗后未进展的所有(无论PD-L1表达状态)不可切除的III期非小细胞肺癌。
该临床试验在全球26个国家的235个中心进行,一共招募了713位患者。主要研究终点是无疾病进展生存期(PFS)和总生存期(OS),次要研究终点包括PFS和OS里程碑时间点分析、客观缓解率和缓解持续时间等。
关于英飞凡
英飞凡(度伐利尤单抗)是一个人源化的PD-L1单克隆抗体,能够阻断PD-L1跟PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并释放被抑制的免疫反应。
除了获批用于III期不可切除的非小细胞肺外,基于CASPIANIII期 临床试验数据,英飞凡已在欧盟、美国、日本和其它多个国家获批用于广泛期小细胞肺癌(ES-SCLC)的治疗。此外,英飞凡还被多个国家批准用于经治的晚期膀胱癌治疗。
作为广泛研发计划的一部分,英飞凡目前正以单独用药或者联合其它抗癌药物的形式,探索在非小细胞肺癌、小细胞肺癌、膀胱癌、肝癌、胆管癌(一种肝脏癌症)、食管癌、胃和胃食管连接部癌、宫颈癌、卵巢癌、子宫内膜癌和其它实体肿瘤等方向的治疗前景。
阿斯利康在肺癌领域的研究
阿斯利康正在努力通过早期疾病的检测和治疗使肺癌患者更接近治愈,并不断推进科学边界,以改善耐药性和晚期肺癌的预后。通过定义新的治疗目标及研究创新的方法,公司旨在通过定义新的治疗目标及研究创新的疗法,将药物带给受益最大的患者。
公司的全面产品组合覆盖领先的肺癌药物和新一代创新药,它们包括泰瑞沙(奥希替尼)和易瑞沙(吉非替尼);英飞凡(度伐利尤单抗)和tremelimumab;与第一三共合作开发的Enhertu(trastuzumab deruxtecan)和datopotamab deruxtecan;与和黄医药合作开发的savolitinib;以及横跨各种作用机制的新药及其组合的产品管线。
阿斯利康是全球Lung Ambition Alliance的创始成员,该联盟致力于加速创新并为肺癌患者带来治疗及治疗以外有意义的改善。
阿斯利康的肿瘤免疫治疗研究
肿瘤免疫治疗是通过激活患者的免疫系统攻击肿瘤的治疗策略。我们的免疫治疗药物组合旨在克服肿瘤对免疫系统的抑制。阿斯利康在肿瘤免疫治疗疗法投入,致力于为各种肿瘤类型的新患者群体提供长期生存获益。
阿斯利康正在探索一项综合性临床试验项目,将度伐利尤单抗单药或度伐利尤单抗联合tremelimumab以及其他新型抗体用于多种肿瘤类型、疾病分期和治疗线数,并在适当时使用PD-L1生物标志物辅助治疗决策,以便为患者提供最佳得治疗策略。另外,我们的免疫治疗药物联合放疗、化疗,以及来自我们公司和合作伙伴的小分子靶向药,将具有为更广泛的癌症患者提供新的治疗策略的潜力。
阿斯利康在肿瘤领域的研究
阿斯利康正引领着肿瘤领域的一场革命,致力提供多元化的肿瘤治疗方案,以科学探索肿瘤领域的复杂性,发现、研发并向患者提供改变生命的药物。
阿斯利康的肿瘤业务专注于最具挑战性的肿瘤疾病,通过持续不断的创新,阿斯利康已经建立了领先全行业的多元化产品组合和渠道,持续推动医疗实践变革,改变患者体验。
阿斯利康以期重新定义癌症治疗并在未来攻克癌症。
参考文献:
1. World Health Organization. International Agency for Research on Cancer. Lung Fact Sheet. Available at https://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf. Accessed May 2021.
2. Cheema PK, et al. Perspectives on Treatment Advances for Stage III Locally Advanced Unresectable Non-Small-Cell Lung Cancer. Curr Oncol. 2019;26(1):37–42.
3. LUNGevity Foundation. Types of Lung Cancer. Available at https://lungevity.org/for-patients-caregivers/lung-cancer-101/types-of-lung-cancer. Accessed May 2021.
4. EpiCast Report: NSCLC Epidemiology Forecast to 2025. GlobalData. 2016.
5. Provencio M, et al. Inoperable Stage III Non-Small Cell Lung Cancer: Current Treatment and Role Of Vinorelbine. J Thorac Dis. 2011;3:197-204.
6. Curran WJ, et al. Sequential vs Concurrent Chemoradiation for Stage III Non–Small Cell Lung Cancer: Randomized Phase III Trial RTOG 9410. J Natl Cancer Inst. 2011;103(19):1452-1460.
7. Hanna N, et al. Current Standards and Clinical Trials in Systemic Therapy for Stage III Lung Cancer: What is New? Am Soc Clin Oncol Educ Book. 2015:e442-447.
8. Anthonia SJ et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2017;377:1919-1929.
9. Antonia SJ, et al. Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med. 2018;379:2342-2350.
10. ASCO. Cancer.net. Lung Cancer – Non-Small Cell. Available at https://www.cancer.net/cancer-types/lung-cancer/view-all. Accessed May 2021.
为你推荐
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
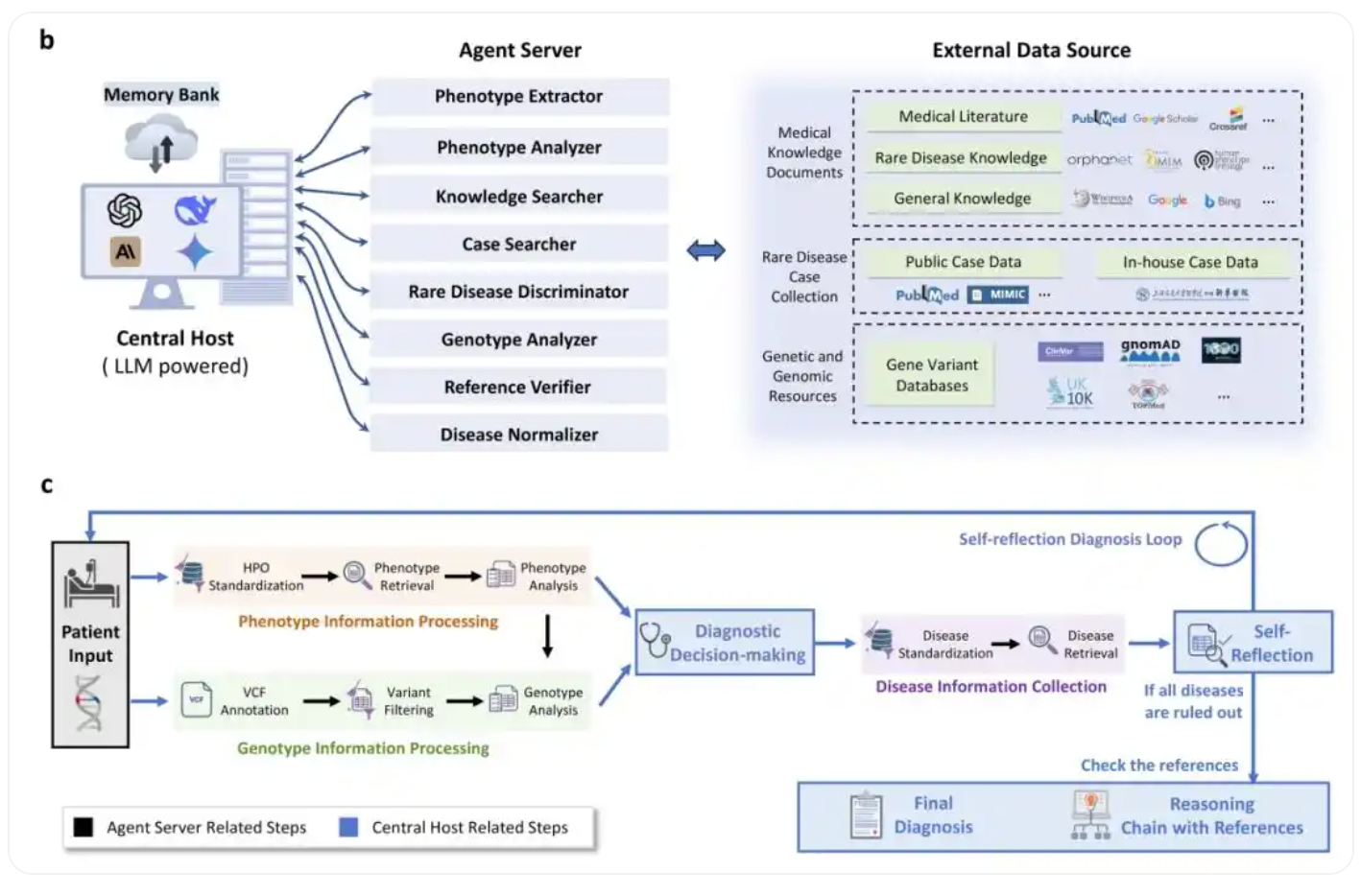
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42
 资讯
资讯 礼来ACHIEVE-3完整数据公布:orforglipron在头对头研究中优于口服司美格鲁肽
2026年2月26日,礼来正式公布了ACHIEVE-3研究的完整数据。该研究结果同步发表于国际权威医学期刊《柳叶刀》。
2026-02-27 11:38
 资讯
资讯 诺和诺德大幅下调司美格鲁肽价格
近日,诺和诺德宣布,将将大幅下调美国的司美格鲁肽药物官方标价(批发采购成本)其中减重版司美格鲁肽Wegovy降幅度50%,降糖版Ozempic降幅约35%。
2026-02-26 13:37
 资讯
资讯 新版《鼓励进口服务目录》发布,生命健康领域有哪些?
2月25日,商务部等七部门联合发布新版《鼓励进口服务目录》,目录主要包含研发设计服务、节能环保服务、环境服务、咨询服务、其他专业服务和医疗与健康服务六大板块。
2026-02-26 11:29
 资讯
资讯 长春高新一项拟用于改善特发性原因导致儿童小阴茎的临床试验获批
2月24日晚间,长春高新(000661 SZ) 发布公告称,旗下核心子公司金赛药业自主研发的GenSci141软膏(双氢睾酮软膏) 正式获得国家药监局临床试验批准通知书。
2026-02-25 22:32
 资讯
资讯 “童颜针”预灌装剂型获批
2月24日,国家药监局发布医疗器械批准证明文件送达信息显示,上海汇悦妍生物科技有限公司全资子公司和妍(上海)医疗器械有限公司申报的“注射用聚左旋乳酸微球填充剂”成功获得...
2026-02-25 14:03
 资讯
资讯 CDE:新药全球同步研发中基于多区域临床试验数据进行获益-风险评估的指导原则(试行)
前是中国审评机构评价MRCT所遵循的主要依据。中国审评机构鼓励申办者基于ICH E17指导原则开展MRCT,加速全球新药在中国市场的同步研发进程,并促进全球新药在中国的同步申报、...
2026-02-25 10:59
 资讯
资讯 李强主持召开国务院常务会议,研究推进银发经济和养老服务发展有关工作
会议指出,我国银发经济潜力很大,要完善支持举措、强化政策落实,促进养老事业和养老产业发展,为应对人口老龄化提供有力支撑。
2026-02-25 10:09
 资讯
资讯 基石药业PD-1在英国获批新适应症
2月24日,基石药业发布公告称,公司PD-1产品舒格利单抗的新适应症申请已获英国MHRA批准,单药用于治疗肿瘤细胞PD-L1表达≥1%、无表皮生长因子受体(EGFR)敏感突变或ALK、ROS1基...
2026-02-24 16:47
 资讯
资讯 9.5亿美元里程碑付款,前沿生物两款小核酸药物授权GSK
2月23日晚间,前沿生物发布公告称,已与全球领先生物制药企业葛兰素史克(GSK)签署独家授权许可协议,葛兰素史克将获得两款小核酸(siRNA)管线产品在全球范围内的独家开发、生...
2026-02-24 13:49