肿瘤液体活检的检测靶标主要包括循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)和外泌体等。尽管近年来ctDNA的研究取得了较大进展,但其作为肿瘤标志物在临床应用中仍存在许多技术问题。本文简单介绍了ctDNA的生物学特性及相关检测面临的挑战,并概述了相关检测试剂的审评思考。
一、循环肿瘤DNA(ctDNA)的生物学特性
生理或病理状态下,细胞坏死或凋亡时细胞核内或线粒体内DNA会释放到血液、胸腔积液、脑脊液、尿液和痰液等体液中。循环游离DNA(cfDNA)是细胞外DNA降解产物,片段大小约150~200 bp。人的cfDNA浓度多低于100μg/L,平均约30μg/L;中晚期肿瘤患者cfDNA浓度可高达1000μg/L,平均约180μg/L。
循环肿瘤DNA(ctDNA)作为cfDNA的一类,来源于肿瘤细胞,主要由单链或双链DNA以及单链与双链DNA的混合物组成,可反映肿瘤的异质性,目前关于ctDNA释放的确切机制尚不明确。健康人中ctDNA的水平很低,肿瘤患者体内可检测到更高水平的ctDNA,且肿瘤患者体内的ctDNA比例与肿瘤负荷呈正相关。ctDNA在cfDNA中的占比较低,中晚期肿瘤患者ctDNA占cfDNA的比例约为8%~10%,在肿瘤早期或治疗缓解后可低至0.01%~1.7%。血液中ctDNA半衰期为15 min至数小时。
ctDNA可反映患者体内肿瘤的全景数据,全面反映与肿瘤组织相同的突变基因组信息,包含突变、缺失、插入、重排、拷贝数异常以及甲基化等相关突变信息。
二、循环肿瘤DNA(ctDNA)的研究进展
在ctDNA研究中,常用的检测技术包括突变扩增阻滞系统(ARMS)、数字PCR(dPCR)及新一代测序(NGS)等,各方法的检测原理、灵敏度、特异性和通量各不相同。低丰度ctDNA对检测技术的灵敏度要求很高。对于ARMS和dPCR,不同方法间的检测差异与样本处理、提取效率、引物位置和探针修饰等有关。对于NGS,其检测灵敏度除与样本处理有关外,还与每一步反应效率和测序深度有关。
研究表明,通过检测ctDNA,可获得肿瘤的相关踪迹信息,ctDNA在肿瘤筛查、早诊诊断、微小残留病灶和复发监测、疗效评价、指导靶向药物使用及生存评估等各方面均具有一定的临床应用前景。
三、循环肿瘤DNA(ctDNA)检测尚存在的问题
目前,ctDNA检测仍面临诸多问题。首先,针对不同种类及不同时期的肿瘤,尚无样本采集、ctDNA提取以及扩增的标准流程。其次,体液中ctDNA会被巨噬细胞实时清除,从而导致体液中ctDNA含量极低,但目前大多数ctDNA研究集中于具有相对高浓度ctDNA的晚期癌症,缺乏早期癌症和低浓度ctDNA的详细经验。
另外,ctDNA检测会出现一定程度的假阴性和假阳性,主要原因是肿瘤的异质性,原发肿瘤、转移性肿瘤、ctDNA三者之间存在差异。而且,肿瘤组织和ctDNA检测标准不一致,导致不同研究给出的一致性数据差异很大。此外,目前ctDNA尚处于小范围研究,不同研究文献得到的结果存在差异,需要进行大量的实验、详细的数据分析,方可证明ctDNA作为肿瘤临床生物标志物的可靠性。
四、循环肿瘤DNA(ctDNA)检测试剂批准概况及审评思考
(一)境内外循环肿瘤DNA(ctDNA)检测试剂批准概况
目前,境内外已批准上市的循环肿瘤DNA检测试剂主要分为两大类:一类是检测血浆等体液中特定基因的甲基化,用于特定肿瘤的辅助诊断或筛查。如:NMPA和美国FDA已相继批准了血浆SEPT9基因甲基化检测试剂,用于特定人群结直肠癌的辅助诊断。NMPA目前批准了肺泡灌洗液中SHOX2、RASSF1A 基因甲基化检测,用于肺癌的辅助诊断等。而且,已批准的ctDNA甲基化检测试剂,均基于荧光定量PCR方法,该方法的检测灵敏度有限。
另一类是检测血浆中特定基因的突变情况,用于特定药物的伴随诊断。如:美国FDA和NMPA相继批准了血浆中EGFR基因的突变检测,用于奥希替尼等的伴随诊断,上述方法均基于荧光定量PCR方法。此外,美国FDA于2020年批准了Guardant Health的Guardant360 CDx血浆ctDNA检测试剂,用于识别表皮生长因子受体(EGFR)基因突变的转移性非小细胞肺癌(NSCLC)患者,这些患者可能会受益于奥西替尼的治疗。这是FDA 批准的首个将NGS和液体活检技术结合,指导临床治疗决策的诊断检测。
(二)循环肿瘤DNA检测试剂的审评思考
1.针对伴随诊断用途,关注血浆循环肿瘤DNA(ctDNA)检测的适用性研究表明,血浆ctDNA中基因突变检测结果与肿瘤组织中的基因突变检测结果存在较大差异,因此,肿瘤组织基因检测依然是目前肿瘤靶向治疗的公认标准。NMPA批准的吉非替尼说明书要求:晚期非小细胞患者治疗前应检测组织EGFR突变,但肿瘤组织不可评估,则可检测血液标本中ctDNA并评估,以鉴别出最可能从吉非替尼治疗中受益的NSCLC患者。2015年,《非小细胞肺癌血液EGFR基因突变检测中国专家共识》也提出当肿瘤组织难以获取时,可将血液EGFR基因突变检测作为合适的替代,作为对可疑组织检测结果的补充。NMPA批准的ctDNA伴随诊断试剂也强调了上述要求。
研究表明,针对不同癌种,血浆ctDNA肿瘤基因突变检测与肿瘤组织基因突变检测的一致性存在较大差异,对于那些检测结果差异较大的癌种,应综合考虑临床应用风险,慎重考虑血浆ctDNA检测试剂作为伴随诊断试剂的可行性,哪些肿瘤患者血浆ctDNA可作为组织基因检测的替代需深入研究,不可盲目申报。
2.针对用于辅助诊断的DNA甲基化检测试剂,关注循环肿瘤DNA(ctDNA)检测的临床意义
应关注特定甲基化基因的临床使用价值。肿瘤基因甲基化研究是目前的热点,针对不同癌种,往往出现多种不同的甲基化基因。在考虑某个甲基化基因是否具有临床转化应用价值时,建议全面调研该甲基化基因的所有相关临床研究资料,系统评价相关临床研究设计是否科学、病例是否充分,得出的结论是否科学可信。在肿瘤发展早期,体液中的循环肿瘤DNA含量较低,甲基化检测的灵敏度较低,可能导致无法满足临床使用需求。
五、小结
尽管研究表明ctDNA 检测在肿瘤诊疗领域显示出良好的应用前景,但仍存在诸多待研究的问题,包括样本处理、检测的标准化、灵敏度、特异性、阳性预测值和临床适用性等。2018年,美国临床肿瘤学会( ASCO) 和病理学家协会(CAP)发表联合评估: 目前ctDNA 在肿瘤早期诊断、微小病变残留检测以及疗效监测的有效性和实用性证据依然不足,除了经过法规审批的经严格验证的ctDNA检测可用于指导靶向治疗外,大多数ctDNA 检测尚需大量实验结果和临床试验的支撑,现阶段不宜在临床广泛开展,后续研究应尽可能纳入预期适用人群,通过严格设计的临床研究来充分验证其临床意义。
参考文献:
1.循环肿瘤DNA检测在恶性肿瘤诊治中的应用进展与问题思考。徐婷等,临床检验杂志,2019(2):81-88。
2.肿瘤液体活检的临床应用与挑战。刘洋等,临床检验杂志,2019(37)8:561-573。
3.循环肿瘤DNA 的临床应用及展望。顾建建等,实用临床医药杂志,2019(23)16:124-128。
4.Merker J D, Oxnard G R, Compton C, et al. Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review[J]. Journal of clinical oncology, 2018: JCO2017768671.
来源:CMDE 中国器审 作者:临床与生物统计二部 刘容枝
为你推荐
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
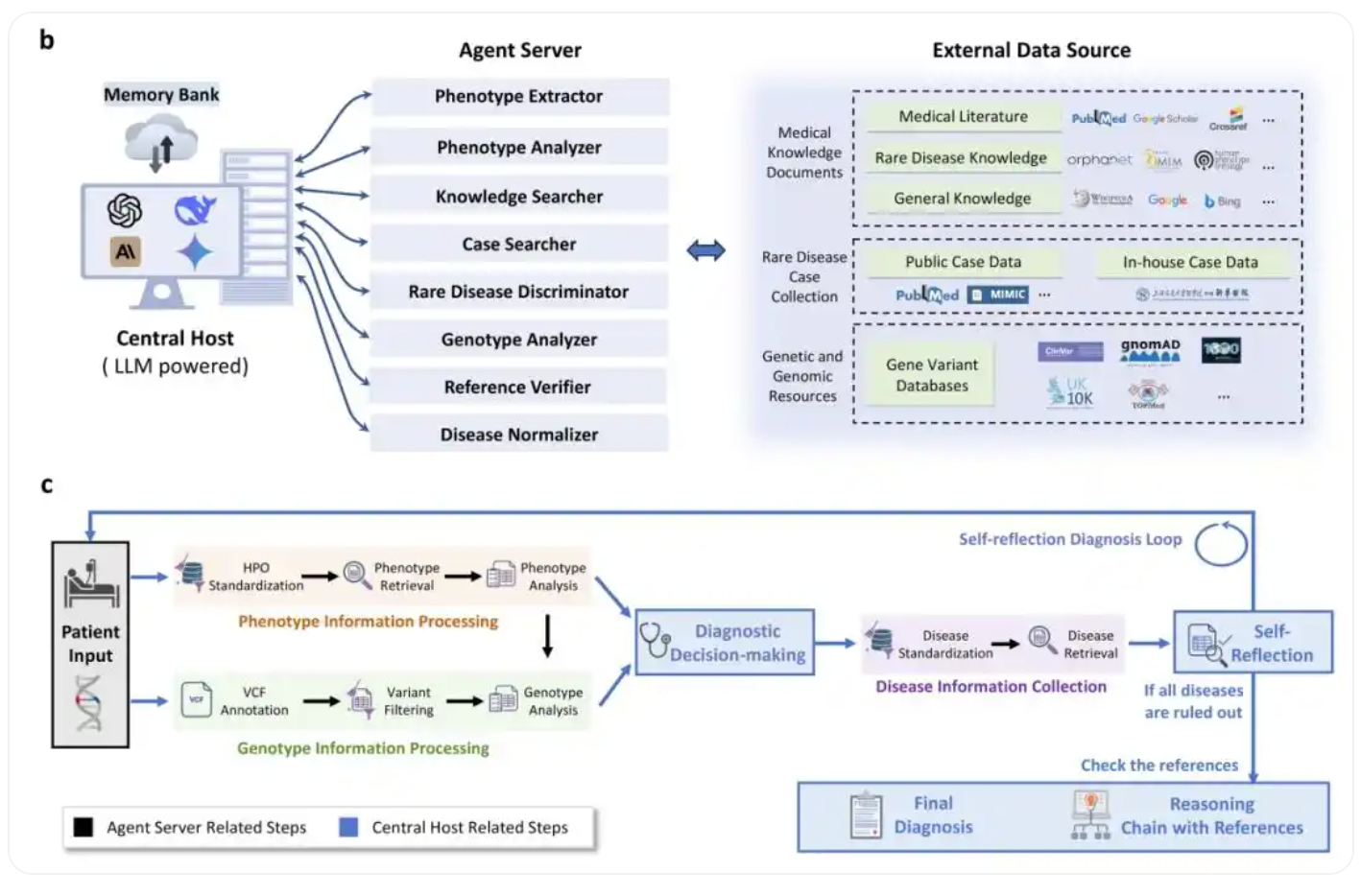
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42
 资讯
资讯 礼来ACHIEVE-3完整数据公布:orforglipron在头对头研究中优于口服司美格鲁肽
2026年2月26日,礼来正式公布了ACHIEVE-3研究的完整数据。该研究结果同步发表于国际权威医学期刊《柳叶刀》。
2026-02-27 11:38
 资讯
资讯 诺和诺德大幅下调司美格鲁肽价格
近日,诺和诺德宣布,将将大幅下调美国的司美格鲁肽药物官方标价(批发采购成本)其中减重版司美格鲁肽Wegovy降幅度50%,降糖版Ozempic降幅约35%。
2026-02-26 13:37
 资讯
资讯 新版《鼓励进口服务目录》发布,生命健康领域有哪些?
2月25日,商务部等七部门联合发布新版《鼓励进口服务目录》,目录主要包含研发设计服务、节能环保服务、环境服务、咨询服务、其他专业服务和医疗与健康服务六大板块。
2026-02-26 11:29
 资讯
资讯 长春高新一项拟用于改善特发性原因导致儿童小阴茎的临床试验获批
2月24日晚间,长春高新(000661 SZ) 发布公告称,旗下核心子公司金赛药业自主研发的GenSci141软膏(双氢睾酮软膏) 正式获得国家药监局临床试验批准通知书。
2026-02-25 22:32