2021年5月14日,渤健公司宣布,氨吡啶缓释片正式获得国家药品监督管理局批准,用于改善多发性硬化(以下简称MS)合并步行障碍(EDSS评分4-7分)成年患者的步行能力。氨吡啶缓释片是中国首个获批的能够改善MS成人患者步行能力的治疗方法。氨吡啶缓释片位列第一批临床急需境外新药名单,其新药上市申请于2021年1月被国家药品监督管理局受理,并于2021年4月被纳入了优先审评审批程序。
“感谢国家药品监督管理局通过优先审评审批程序批准氨吡啶缓释片,这是渤健今年在中国获批的第二个MS治疗药物。“渤健亚太区总裁温浩基表示,“渤健致力于将我们在MS领域超过25年的创新优势和未来更多创新药物带到中国,并和政府、医学界、患者组织和社会各方积极合作,助力中国MS诊疗水平的提升,造福中国MS患者。”
氨吡啶缓释片是首个具有改善MS成人患者的步行能力,并在MS成人患者中证明了其临床疗效的治疗药物。国家药品监督管理局的药品审评参考了三项全球3期、随机、双盲、安慰剂对照的验证性研究,结果显示,氨吡啶缓释片治疗的患者步行速度显著高于安慰剂组,且氨吡啶缓释片治疗应答时间短,治疗启动后数周即显示出疗效。
2018年5月,MS被列入《第一批罕见病目录》。MS是一种累及中枢神经系统的终身性、进展性的自身免疫疾病,中枢神经系统受累逐渐引起肢体残疾,并损害运动、视觉和认知等神经系统功能。MS患者可出现广泛多样的神经功能缺损,包括步行能力障碍、疲乏、痉挛状态、共济失调、疼痛、震颤和无力。由于步行需要对运动、感觉、视觉、小脑和前庭功能系统进行有效协调,因此步行能力障碍是MS的一个关键不良特征。高达85%的MS患者将步行障碍视为他们的初始症状[1],因此MS患者和神经科医生均认为步行障碍对正常日常功能和总体生活质量产生最大的不良影响。
“多发性硬化是目前全球年轻成人群体非创伤性神经系统性残疾的主要原因,几乎所有的多发性硬化症患者最终会经历不同程度的行走障碍。这一临床结局会极大影响患者的独立性,不但限制他们的工作能力,还会造成患者沉重的精神负担,并对他们个人及家庭产生严重的负面影响。” 首都医科大学附属北京天坛医院院长,国家神经系统疾病临床医学研究中心副主任,中华医学会神经病学分会主任委员王拥军教授表示:“氨吡啶缓释片是目前唯一被美国FDA和欧盟EMA批准针对于改善MS患者步行能力的药物。它与疾病修正治疗药物联合使用,提供了短期改善步行能力,长期减少疾病致残的综合治疗方案。”
2020年12月,由中国罕见病联盟发布的《2020中国多发性硬化患者综合社会调查报告》显示,处于辍学或失业状态的MS患者中,近90%是由该疾病导致的。超过50%的患者不能自己照顾自己,需要他人照料。申领了残疾证的MS患者的残疾等级较高,一级、二级超过50%,其中近90%为肢体残疾。
氨吡啶缓释片是渤健在中国市场获批的第二个MS治疗药物。2021年4月,渤健药物富马酸二甲酯肠溶胶囊获得中国国家药品监督管理局批准,用于治疗复发型多发性硬化。渤健在MS领域有超过25年的创新优势,有6个获批产品,25项正在进行中的临床研究项目,全球超过130万MS患者受益于渤健药物。
关于氨吡啶缓释片
氨吡啶缓释片是一种适用于改善多发性硬化(MS)成人患者步行能力的治疗方法。渤健公司获得了Acorda Therapeutics Inc的许可,可在美国以外的全球市场开发并推广氨吡啶缓释片。
氨吡啶缓释片是首个同时具有改善MS成人患者步行能力,且具MS临床疗效的药物。氨吡啶缓释片可单独使用或与疾病修正治疗(包括免疫调节药物)联合使用。在临床试验中,对氨吡啶缓释片治疗产生应答的患者行走速度平均增加25%,显示其具有显著改善行走能力方面的疗效。
在治疗MS患者的安慰剂对照试验中,氨吡啶缓释片治疗组最常见的不良反应为尿路感染(约12%的患者),但细菌培养通常为阴性。药物不良反应主要分为神经系统相关(如失眠、平衡障碍、头晕、感觉异常、头痛、焦虑和震颤)和胃肠道相关(包括恶心、呕吐、消化不良和便秘)。其他常见药物不良反应为乏力、背痛、咽喉痛和呼吸困难。在上市后经验中,在有三叉神经痛(TN)病史的患者中报道了癫痫发作、超敏反应(包括过敏反应)和TN加重。由于这些反应是基于不确定人数的自愿报告,所以常不能可靠地估算其发生率或确立不良事件与药物暴露的因果关系。
关于渤健
在渤健,我们的使命清晰明确:我们是神经科学领域的先锋。渤健为全球罹患严重神经和神经退行性疾病的患者探寻、研发和提供创新疗法和相关方案。渤健是 Charles Weissmann、Heinz Schaller、Kenneth Murray 与诺贝尔奖获得者 Walter Gilbert 和 Phillip Sharp 携手在 1978 年成立的全球首批生物技术公司之一。当前,渤健拥有治疗多发性硬化的领先药物组合,推出了第一个批准用于脊髓性肌萎缩症的治疗药物,并提供先进生物制剂的生物类似药。渤健专注于推进多发性硬化和神经免疫学、阿尔茨海默病和痴呆、神经肌肉疾病、运动障碍、眼科、免疫学、神经认知障碍、神经科急症、神经性疼痛等领域的科学研究项目。
Reference:
[1] Scheinberg L, Holland N, Larocca N, et al. Multiple sclerosis; earning a living. New York state journal of medicine. 1980;80(9):1395-400
来源:医谷网
为你推荐
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
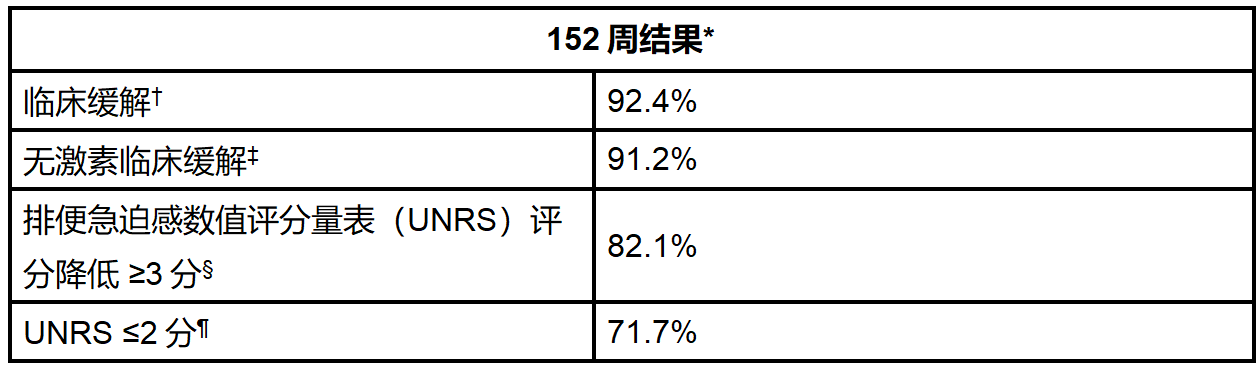
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58










