1月7日,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》,成为依据真实世界研究(Real World Evidence,RWE)进行药物研发的里程碑事件。
什么是真实世界证据?
《原则》明确,真实世界证据是指通过对适用的真实世界数据进行恰当和充分的分析所获得的关于药物的使用情况和潜在获益-风险的临床证据,包括通过对回顾性或前瞻性观察性研究或者实用临床试验等干预性研究获得的证据。
真实世界数据是指来源于日常所收集的各种与患者健康状况和/或诊疗及保健有关的数据。并非所有的真实世界数据经分析后都能成为真实世界证据,只有满足适用性的真实世界数据才有可能产生真实世界证据。
真实世界数据的常见来源包括但不限于:卫生信息系统(Hospital Information System,HIS),医保系统,疾病登记系统,国家药品不良反应监测哨点联盟,自然人群队列和专病队列数据库,组学相关数据库,死亡登记数据库,患者报告结局数据,来自移动设备端的数据等。
如何进行真实世界研究?
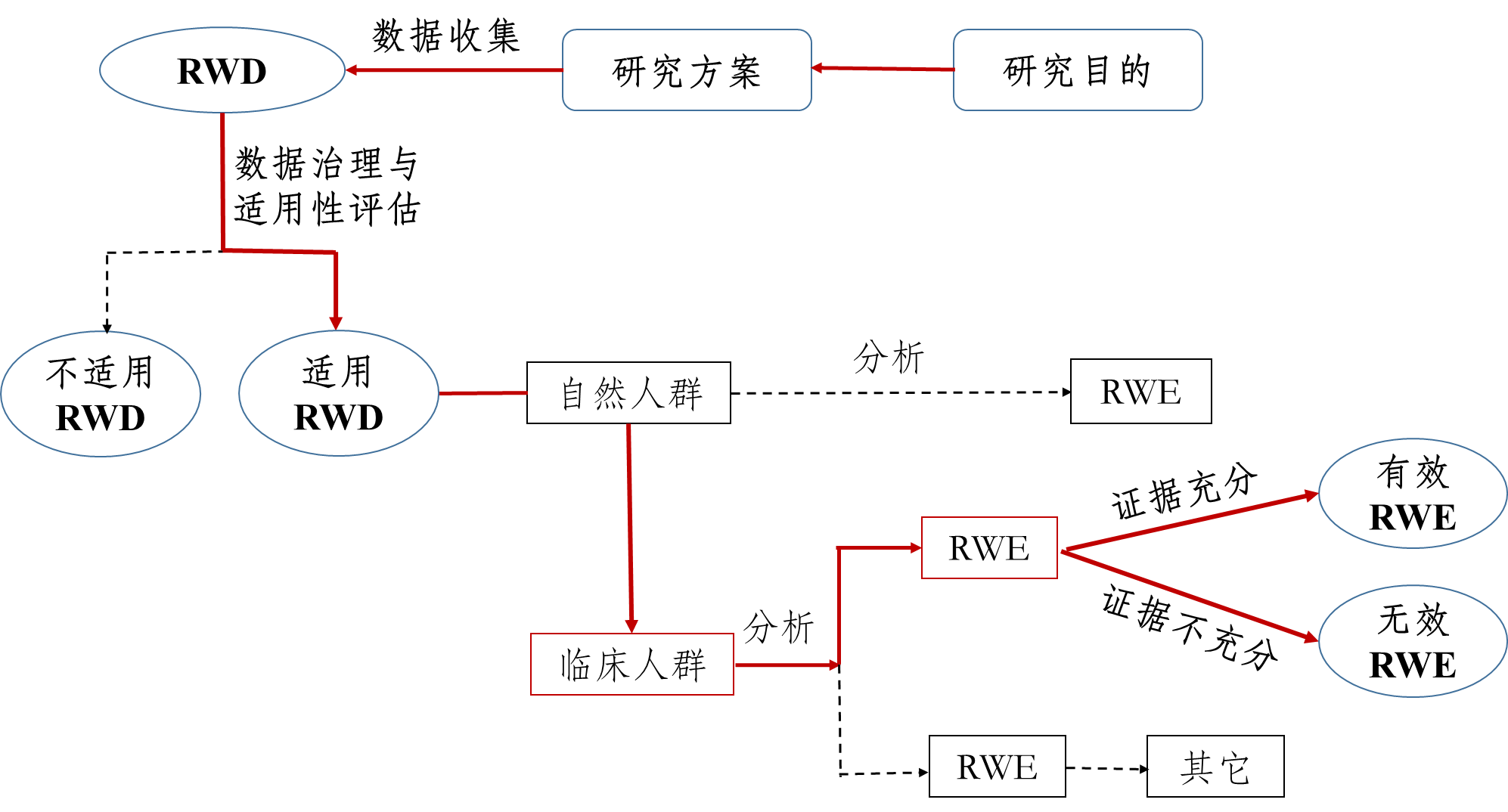
《原则》指出,真实世界研究是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程(如图1所示)。
图1支持药物监管决策的真实世界研究路径(实线所示)
真实世界证据支持药物监管决策的主要应用范围
真实世界证据应用于支持药物监管决策,涵盖上市前临床研发以及上市后再评价等多个环节。例如,为新产品批准上市提供有效性或安全性的证据;为已获批产品修改说明书提供证据,包括增加或修改适应症,改变剂量、给药方案或给药途径,增加新适用人群,增加实效比较信息,增加安全性信息等;作为上市后要求的一部分支持监管决策的证据等。
真实世界证据支持药物监管决策的主要应用范围有:
1.为新药注册上市提供有效性和安全性的证据
根据不同疾病的特征、治疗手段的可及性、目标人群、治疗效果和其它与临床研究相关的因素等,可以通过真实世界研究获得药物的效果和安全性信息,为新药注册上市提供支持性证据。
2.为已上市药物的说明书变更提供证据
对于已经上市的药物,新增适应症通常情况下需要RCT支持。但当RCT不可行或非最优的研究设计时,采用PCT或观察性研究等生成的真实世界证据支持新增适应症可能更具可行性和合理性。
真实世界证据支持已上市药物的说明书变更主要包括以下几种情形:
增加或者修改适应症;改变剂量、给药方案或者用药途径;增加新的适用人群;添加实效比较研究的结果;增加安全性信息;说明书的其它修改。
3.为药物上市后要求或再评价提供证据
基于RCT证据获批的药物,通常由于病例数较少、研究时间较短、试验对象入组条件严格、干预标准化等原因,存在安全性信息有限、疗效结论外推不确定、用药方案未必最优、经济学效益缺乏等不足,需要利用真实世界数据对药物在真实医疗实践中的效果、安全性、使用情况,以及经济学效益等方面进行更全面的评估,并不断根据真实世界证据做出决策调整。
4.名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发
对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
5.真实世界证据用于监管决策的其它应用,包括指导临床研究设计和精准定位目标人群等。
真实世界研究的意义和价值
相对于传统的药物临床试验的随机对照试验(Randomized Controlled Trial,RCT)方法,在评价药物安全性和有效性时常常会带来时间久、成本高的代价,如业内共识一款新药平均研发10年、成本10亿美金的说法,最近几年,这个成本还在上升。
而真实世界研究,不仅可以利用真实世界数据支持审评,可以部分取代目前药物研发中的临床试验,节省药物研发成本。此外,真实世界数据有些是前瞻性的,也有一些是回顾性的,基于历史数据进行注册审批,还能缩减药品审批上市的时间,受到药企欢迎。
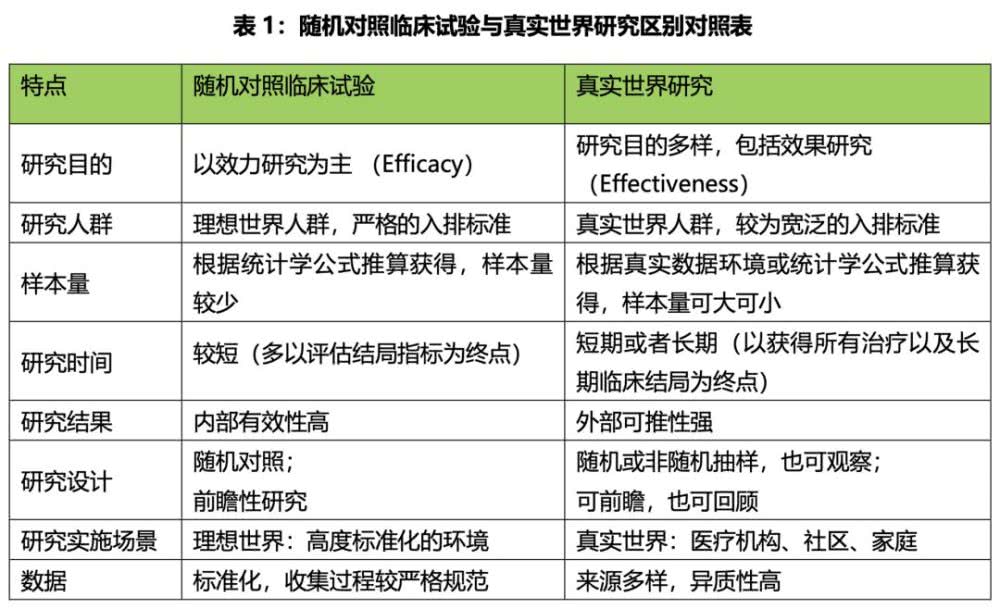
RCT与RWE对比
来源:《真实世界研究指南2018版》(由吴阶平医学基金会肿瘤医学部主委吴一龙牵头组织相关专家撰写)
基于此,《原则》中也列举了两项真实世界证据的研究案例:
示例1:利用真实世界证据支持新增适应症
申办方在某药上市后发起一项通过真实世界数据评价其在中国女性中减少临床骨质疏松性骨折的有效性和安全性研究。该研究遵循真实世界研究的良好实践,研究方案事先公开。真实世界数据来源具有良好的研究人群代表性,样本量达4万余人,该研究的主要终点通过病历审查进行验证,以倾向评分匹配作为主要分析方法,同时使用逆概率加权法、高维倾向评分调整等多种方法进行敏感性分析,并定量评估未测量到的混杂因素的影响。该真实世界研究的结果与全球RCT研究相近,并用不同数据来源、不同研究机构的真实世界数据重现出该结果。
示例2:利用真实世界证据支持扩大联合用药
贝伐珠单抗(Bevacizumab)是一种血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)人源化单克隆抗体制剂,于2015年在中国获批联合化疗(卡铂与紫杉醇)用于不可切除的晚期、转移性或复发性非鳞状非小细胞肺癌患者的一线治疗。真实世界中患者所联合的化疗方案并不局限于卡铂与紫杉醇,还包括培美曲塞联合铂类、吉西他滨联合顺铂等。2018年10月该药获批将治疗方案扩展为联合以铂类为基础的化疗方案,其中三项真实世界研究结果提供了强有力的支持证据。这三项研究回顾性分析了三家医院的患者数据,均显示在含铂双药化疗基础上联合贝伐珠单抗较单纯化疗显著延长PFS和OS,与全球人群数据具有一致性,并且未发现新的安全性问题。此外,相关真实世界研究还提供了EGFR突变和脑转移等不同患者亚组中的疗效数据,从多角度证实了贝伐珠单抗联合疗法的有效性和安全性。
附全文
来源:医谷网
为你推荐
 资讯
资讯 从收费难题到医保立项:机器人诊疗迎来普及拐点
2025年12月5日,国家医保局向各省医保局下发了《手术和治疗辅助操作类医疗服务价格项目立项指南(征求意见稿)》,用于在医保体系内部征求意见。
文/梁瑜 2026-01-21 16:48
 资讯
资讯 英矽智能6600万美元授权一款具有穿透血脑屏障的潜在在研抗炎药物
1月20日,英矽智能发布公告称,与深圳衡泰生物科技有限公司就 ISM8969 项目达成共同开发合作协议。
2026-01-21 15:42
 资讯
资讯 国家医保局规范手术和治疗辅助操作类医疗服务价格,手术机器人有了系统明确收费指引
近日,国家医保局编制印发《手术和治疗辅助操作类医疗服务价格项目立项指南(试行)》,将已有价格项目规范整合为37项,覆盖医学3D重建、生物3D打印、术中显微成像、手术路径导...
2026-01-21 15:12
 资讯
资讯 GSK22亿美元收购间接获得中国创新药资产
1月20日,GSK(葛兰素史克)宣布与RAPT Therapeutics达成最终收购协议,根据协议条款,葛兰素史克将以每股58 00美元的现金价格收购RAPTTherapeutics全部已发行普通股,对应股...
2026-01-21 14:33
 资讯
资讯 182家单位入围2025年人工智能医疗器械创新任务揭榜挂帅,都有哪些项目
近日,工信部办公厅 与国家药监局综合和规划财务司公布2025年人工智能医疗器械创新任务揭榜挂帅入围单位。
2026-01-21 10:32
 资讯
资讯 上海医药iNKT细胞注射液获批临床试验
1月20日,上海医药集团股份有限公司发布公告称,下属上海医药集团生物治疗技术有限公司自主研发的“B023细胞注射液”收到国家药品监督管理局核准签发的《药物临床试验批准通知书...
2026-01-20 16:49
 资讯
资讯 蚂蚁阿福升级PC端,面向医生群体上线 DeepSearch功能
今日,蚂蚁阿福升级其 PC 端,并上线DeepSearch(深度搜索)功能打造中国版“Open Evidence”,免费为医生、医学生及基层医疗工作者等泛医学人士提供专业服务。蚂蚁阿福 PC...
2026-01-20 15:56
 资讯
资讯 可突破血脑屏障,FDA受理非小细胞肺癌创新药上市申请
近日,美国生物医药公司Nuvalent宣布,美国FDA已受理其为zidesamtinib递交的新药申请(NDA)
2026-01-20 11:41
 资讯
资讯 核药创新再破局!远大医药TLX591-CDx国内NDA获受理
远大医药(0512 HK)再度传来核药重大利好——公司用于诊断前列腺癌的创新放射性核素偶联药物(RDC)TLX591-CDx向国家药监局递交的新药上市申请(NDA)已获受理。
2026-01-19 21:29
 资讯
资讯 eCTD验证软件更新V1.1.0版,3月1日起,V1.0版及配套操作手册将不再适用
本次更新内容主要包括新增原料药申请验证规则,调整PDF文件书签、超链接和文件大小验证规则、完善部分文字描述等。
2026-01-19 14:18
 资讯
资讯 阿斯利康获得西比曼靶向GPC3细胞疗法剩余50%的全球权益
1月16日,西比曼生物科技宣布与阿斯利康达成协议,后者将收购西比曼在中国对C-CAR031的开发和商业化权益的50%份额,由此阿斯利康将获得C-CAR031在全球范围内开发、生产和商业化...
2026-01-19 13:19
 资讯
资讯 2025年国民经济数据:16—59岁人口85136万人,占全国人口的比重为60.6%;60岁及以上人口32338万人,占全国人口的23.0%
全年出生人口792万人,人口出生率为5 63‰;死亡人口1131万人,人口死亡率为8 04‰;人口自然增长率为-2 41‰。
2026-01-19 11:41
 资讯
资讯 2026年1月14日起,均适用《Q8、Q9和Q10问答(R5)》国际人用药品注册技术协调会指导原则
自2026年1月14日起开始的相关研究,均适用《Q8、Q9和Q10问答(R5)》。
2026-01-19 11:24
 资讯
资讯 糖尿病治疗1类创新药奥洛格列净胶囊获批
1月16日,国家药监局官网信息显示,近日,国家药品监督管理局批准宜昌东阳光长江药业股份有限公司申报的1类创新药奥洛格列净胶囊(商品名:东泽安)上市,该药适用于改善成人2型...
2026-01-17 23:20
 资讯
资讯 CDE:中药复方制剂新药研发人用经验收集整理技术指导原则(试行)
人用经验是“三结合”中药注册审评证据体系的重要环节。如何产生可评价的人用经验、怎样收集整理人用经验数据,对于筛选确定临床有效处方、合理利用人用经验支持后续研发及决策...
2026-01-16 21:09