2025年3月31日,百时美施贵宝宣布,旗下两款肿瘤免疫治疗药物——欧狄沃®(纳武利尤单抗注射液)与逸沃®(伊匹木单抗注射液)的联合疗法获得中国国家药品监督管理局(NMPA)批准新增适应症,适用于不可切除或晚期肝细胞癌(HCC)成人患者的一线治疗,成为中国首个且目前唯一获批的肝细胞癌一线双免疫联合疗法。此次获批基于III期CheckMate -9DW研究,该研究在全球范围内首次证实免疫治疗方案用于肝细胞癌一线治疗,疗效可显著优于两种既往标准治疗药物(仑伐替尼或索拉非尼)。
“肝癌在中国的疾病负担尤为沉重,发病人数位居全球第一,每年导致的癌症死亡人数也高居所有癌症第二。其中,肝细胞癌是最常见的肝癌类型,占所有肝癌的90%;尽管免疫治疗的应用提升了晚期患者的获益,但现有方案在缓解率、缓解持续时间等方面仍存在未被满足的需求,整体疗效亟待进一步提升。” 中国科学院院士、复旦大学附属中山医院名誉院长樊嘉教授表示,“因此,我们非常惊喜地看到纳武利尤单抗与伊匹木单抗凭借独特的‘双免联合’策略,在CheckMate-9DW研究中表现出极为令人印象深刻的疗效数据,并且进一步改善了患者生存。也很高兴看到此次这一方案能在国内获批,开启了中国肝细胞癌治疗的‘双免时代’,为广大患者带来了福音。”
CheckMate-9DW是一项全球多中心、III期随机对照研究,评估了欧狄沃联合逸沃方案对比研究者选择的仑伐替尼或索拉非尼,在不可切除的肝细胞癌一线治疗患者中的疗效和安全性,其中85%的对照组患者使用了仑伐替尼。研究主要终点结果显示,欧狄沃联合逸沃组的中位总生存期(mOS)为23.7个月(对照组为20.6个月),显著降低21%的死亡风险(HR 0.79,p=0.018)。次要终点方面,欧狄沃联合逸沃组的客观缓解率(ORR)为36%,相比对照组(13%)改善近3倍;中位缓解持续时间(mDOR)可达30.4个月,较对照组(12.9个月)改善2倍以上。研究中,欧狄沃联合逸沃方案整体安全性可控,未发现新的安全性信号,3/4级治疗相关不良事件发生率为41%(对照组42%)。
“迄今为止,在肝细胞癌一线治疗领域,CheckMate-9DW是唯一的头对头对比双免疫检查点抑制剂(即纳武利尤单抗联合伊匹木单抗)与两种标准治疗药物(索拉非尼或仑伐替尼)的关键性III期临床试验,且其中大多数对照组患者是应用具有一定优势的分子靶向药物仑伐替尼。即便如此,该试验仍然获得了预期的阳性结果,不仅充分表明双免方案的有效性证据极为坚实,也填补了符合循证医学研究中的一项空白,因此具有十分重要的科学意义和实用价值。”CheckMate-9DW中国主要研究者、中国药科大学附属南京天印山医院的秦叔逵教授表示,“上述有关研究数据证实:双免方案不仅缓解率高,而且一旦起效,缓解持续时间(DOR)和总生存期(OS)都显著延长,说明该方案兼具出色的短期客观疗效和优异的长期生存获益;加之其安全性可控、且伊匹木单抗最多使用4个周期,没有见到新的安全信号,有利于临床管控和选择合适的患者。我们期待该方案获批新的适应症之后,助力中国肝细胞癌的临床整体疗效更上一层楼。”
欧狄沃联合逸沃方案的疗效优势,得益于两种药物高度协同的作用机制: CTLA-4抑制剂逸沃主要作用于T细胞启动和活化阶段,可促进T细胞的激活和增殖,其独有的免疫调节细胞(Treg)清除功能还可有助于改善肝癌肿瘤微环境的免疫抑制状态,进一步增强免疫抗肿瘤作用;而PD-1抑制剂欧狄沃主要作用于T细胞的效应阶段,帮助激活后的T细胞识别、杀灭肿瘤细胞。基于独特的作用机制和临床研究证据,欧狄沃联合逸沃方案目前已在中国获批用于胸膜间皮瘤、结直肠癌、肝细胞癌等多个癌种。
“我们十分高兴地看到,‘免疫双子星’欧狄沃联合逸沃能以接近全球同步的速度在中国获批肝细胞癌一线新适应症。对此,我们由衷感谢监管部门不断深化审评审批制度改革,让创新药物的落地得以持续加速,为广大中国患者带来了实实在在的福祉。”百时美施贵宝副总裁、中国及亚洲区域市场总经理、中国区总裁陈思渊女士表示,“作为肿瘤免疫治疗领域的先行者、引领者,百时美施贵宝将在公司「中国2030战略」的指引下,持续并专注深耕创新疗法在中国高发瘤种中的应用,填补临床的未尽之需;并与各方携手,助力提升药物可及,改变患者生命。”
作为首个将肿瘤免疫治疗药物引入中国的企业,百时美施贵宝始终高度关注中国肿瘤患者的治疗经济负担和可及性,并于2018年携手中国癌症基金会(CFC),发起了中国首个肿瘤免疫治疗药物患者援助项目——欧狄沃患者援助项目。伴随此次获批,欧狄沃患者援助项目将新增欧狄沃用于肝细胞癌一线治疗适应症的援助方案,帮助患者切实降低创新治疗的支付负担,获得更多的生存希望。
为你推荐
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
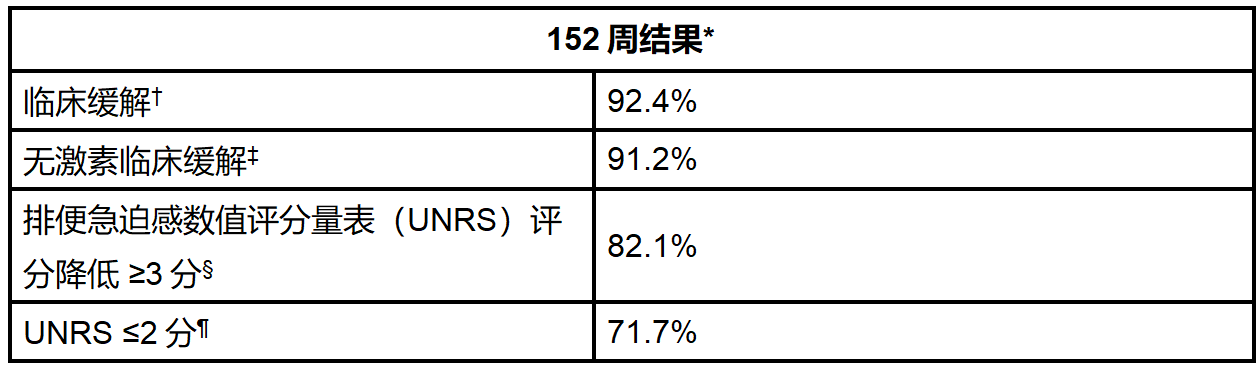
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23









