1月2日,中国国家药品监督管理局(NMPA)正式宣布批准了赫双妥®(通用名:帕妥珠曲妥珠单抗注射液(皮下注射)),用于治疗成人HER2阳性早期和转移性乳腺癌患者。全新的赫双妥®作为全球首个复方皮下制剂,突破肿瘤单抗类药物给药技术瓶颈,“帕妥珠、曲妥珠双剂合一”只需5-8分钟就可以完成治疗,彻底革新乳腺癌靶向治疗传统模式,为中国的乳腺癌患者提供更加便捷、高效和安全的治疗选择。
妥妥“愈”她,双靶开拓乳腺癌从“治”到“愈”新思路
据世界卫生组织最新的数据,乳腺癌已取代肺癌成为全球第一大肿瘤。2020年中国女性新发乳腺癌病例超过41.6万[1],发病率为39.1/10万,每年因乳腺癌死亡人数约11.7万[2]。HER2阳性乳腺癌约占所有乳腺癌病例的20%-30%,其恶性程度高、复发转移率高且易发生淋巴结转移,预后较差,一度被称为“最凶险的乳腺癌”。
20年前,创新靶向药物赫赛汀®(注射用曲妥珠单抗)改变了HER2阳性乳腺癌患者的结局,1年曲妥珠单抗标准辅助治疗后,约75%的患者达到10年无病生存[3-6],彻底改变了HER2阳性乳腺癌患者的结局。其后,一系列研究证实,帕捷特®(帕妥珠单抗注射液)联合赫赛汀用于HER2阳性乳腺癌患者术前辅助治疗、术后辅助治疗,乃至治疗晚期乳腺癌,都可以进一步减少复发风险,延长患者的生命[7-10]。帕妥珠单抗与曲妥珠单抗协同互补的作用机制可以更强抑制肿瘤生长,带给HER2阳性乳腺癌患者从早期到晚期“妥妥”的长期获益。截止到目前,全球有超过75个国家批准帕捷特联合赫赛汀用于HER2阳性乳腺癌患者的新辅助,辅助及晚期一线治疗。
我国也于2019年批准帕捷特与赫赛汀联合治疗HER2阳性乳腺癌。目前,我国早期HER2阳性乳腺癌患者5年生存率超过90%[11],已率先于其它肿瘤步入临床治愈时代。
“妥妥”升阶,创新以患者为本“愈”她一步到位
与西方国家相比,我国乳腺癌的发病年龄较早,发病高峰在45-55岁,而西方国家多在65岁之后[12]。乳腺癌对中国患者正常工作生活的影响甚至更大,患者对治好病到重新回归社会的需求也更强烈。因此在“后治愈”时代,如何进一步满足乳腺癌患者的更高需求,让患者更有尊严地回归生活、重归社会的需求变得更加迫切。
肿瘤皮下制剂打破了现有静脉治疗局限,通过快速便捷的给药方式大幅缩短了患者及家属在院时间;将本需要数个小时的住院治疗时间大幅缩短到了5到8分钟,快速推动肿瘤靶向治疗门诊化、社区化、家庭化。此外,皮下给药方式创伤小,在提升患者治疗舒适度的同时豁免了静脉血栓等风险,也帮助患者和家属节约住院、建立静脉通路和照顾护理等费用,大幅节省医疗资源和社会成本,也在最大程度上让肿瘤治疗不中断患者的正常工作和生活成为可能。
赫双妥®作为全球首个固定剂量的复方皮下制剂,彻底革新乳腺癌诊疗模式。区别传统静脉治疗方式,赫双妥®是将曲妥珠单抗和帕妥珠单抗两药组合的即用型、固定剂量,通过大腿皮下注射给药的复方制剂。其采用新型药物递送技术,实现了双单抗剂量浓缩为固定剂量。“双剂合一”操作简单,仅需5-8分钟就可以完成治疗。重组人透明质酸酶(rHuPH20)能够暂时降低细胞间质的粘性,促进药物快速扩散和吸收,注射后皮下原有结构将快速恢复,不易鼓包,且患者无明显疼痛感。其以灵活、便捷,一步到位的治疗体验,让我国乳腺癌患者向着身心治愈的目标更进一步。
此外,为顺应健康中国2030“以人民健康为中心”核心理念和肿瘤慢病化管理要求,罗氏经典抗HER2产品赫赛汀®SC(通用名:曲妥珠单抗注射液(皮下注射))获批仅一年后,并在2023年12月13成功纳入国家医保目录,让我国乳腺癌患者率先从创新药物和升级诊疗方案中获益,彰显了国家政府对乳腺癌患者的关注和对深化医疗保障制度的决策部署。
全新“妥妥”超越经典疗效,为医护患带来多方获益
本次赫双妥®的获批主要依据FeDeriCa临床研究。FeDeriCa研究是一项全球三期随机、开放标签及国际多中心的非劣效临床试验,将HER2阳性乳腺癌患者1:1随机分组,分别接受曲帕双靶静脉治疗与曲帕双靶皮下制剂治疗,进而比较两者在药代动力学、疗效与安全性的差异。研究结果显示赫双妥®与曲帕双靶静脉治疗在血清药物浓度、病理完全缓解率以及不良反应发生率方面并无显著差异。
同时,探讨了患者对双靶静脉注射与皮下注射偏好的PHranceSCa研究显示,85%的接受双靶治疗的HER2阳性乳腺癌患者更倾向选择赫双妥®;在第6周期后,136/160例患者(85%)报告首选赫双妥®皮下注射给药,最常见的原因是门诊给药所需的时间较短[13]。同时,PHranceSCa研究再次印证,赫双妥®与已知的曲帕双靶静脉制剂获益一致,并且安全性与静脉制剂相比也无显著差异[14]。
罗氏全球药品开发中国中心负责人李昕博士表示:“赫双妥®在给药方式上较传统的静脉注射有显著改进,不仅降低了治疗成本、节省治疗时间,还大幅提高了患者依从性,患者感受和相应的医疗资源的损耗等也都较以往静脉给药有很大程度的改善。本次赫双妥®的获批向可以帮助让乳腺癌患者‘用最少时间做病人,更多时间做自己’的梦想早日实现。”
罗氏制药中国总裁边欣表示:“肿瘤治疗进入皮下时代是全球发展的趋势和前沿,这意味着肿瘤患者的治疗模式向慢病化管理转变成为可能。秉承着“先患者之需而行”的理念,罗氏制药中国将继续积极与各方合作,聚焦探索‘以患者为中心’的肿瘤诊疗新生态,帮助更多的乳腺癌及其他肿瘤患者最大限度摆脱疾病治疗的束缚,回归幸福美好生活。”
参考文献:
[1]《2020年全球癌症负担报告》(Global Cancer Burden in 2020,IARC)
[2]https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa/文中数据全部来自:世界卫生组织国际癌症研究机构
[3]PEREZ EA,,et al.Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer:planned joint analysis of overall survival from NSABPB-31 and NCCTGN9831[J].J clin oncol 2014,32(20):3744-3752.
[4].De Azambuja E,et al.Trastuzumab—associ ated cardiac events at 8 years of median follow-up in the HERceptin Adjuvant trial(BIG1-01)[J].J clin oncol,2014,32(20):2159-2165.
[5]Romond EH,et al.Seven year follow-up assessment of cardiac functionin NSABPB-31.a randomized trial comparing doxombicin and cyclo-phosphamide followed by paclitaxel(ACP)with ACP plus trastuzumab as adjuvant therapy for patients with nodepositive,human epidermal growth factor recept or 2-positive breast cancer[J].J clin oncol 2012(30):3792-3799.
[6]Camerond D,et al.11 years’follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer:final analysis of the Herceptin Adjuvant(HERA)trial[J].The Lancet,2017,389(10075):1195.
[7]Camerond D,et al.11 years’follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer:final analysis of the Herceptin Adjuvant(HERA)trial[J].The Lancet,2017,389(10075):1195.
[8]Eight-year data from APHINITY study show Roche’s Perjeta-based regimen continues to reduce the risk of disease returning for people with HER2-positive early breast cancer.https://www.roche.com/media/releases/med-cor-2022-07-14b
[9]Gianni l,et al.Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone,in patients with HER2-positive locally advanced breast cancer(the NOAH trial):a randomised controlled superiority trial with a parallel HER2-negative cohort[J].Lancet.2010 Jan 30;375(9712):377-84.
[10]Gianni L,et al.5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced,inflammatory,or early-stage HER2-positive breast cancer(NeoSphere):a multicentre,open-label,phase 2 randomised trial.Lancet Oncol.2016 Jun;17(6):791-800.
[11]https://shmc.fudan.edu.cn/news/2022/0221/c1893a130223/page.htm
[12]https://mp.weixin.qq.com/s/CvvdSgBMH1W-hpEdHi0lSQ
[13]Jackisch C et al,Adv Ther.2022 Feb;39(2):833-844.
[14]O‘Shaughnessy J,et al.2023 ESMO BC Abstract 97P
来源:医谷网
为你推荐
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
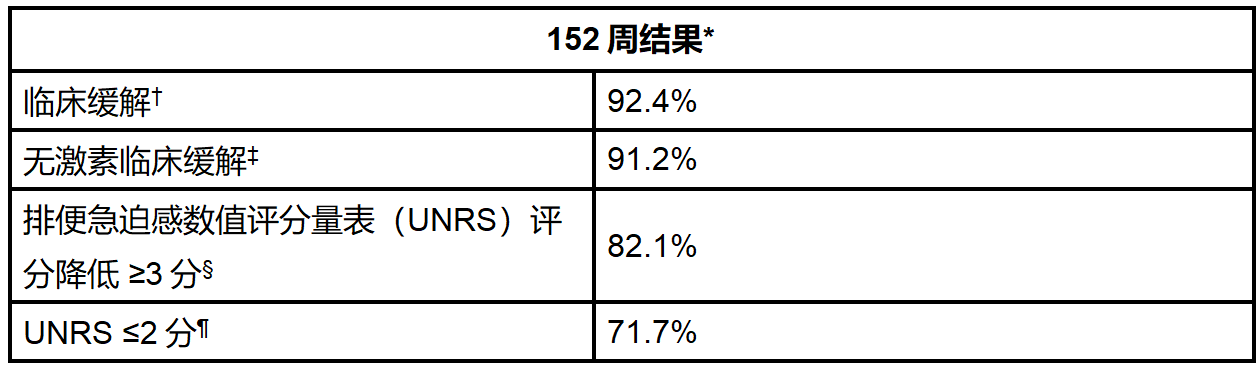
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
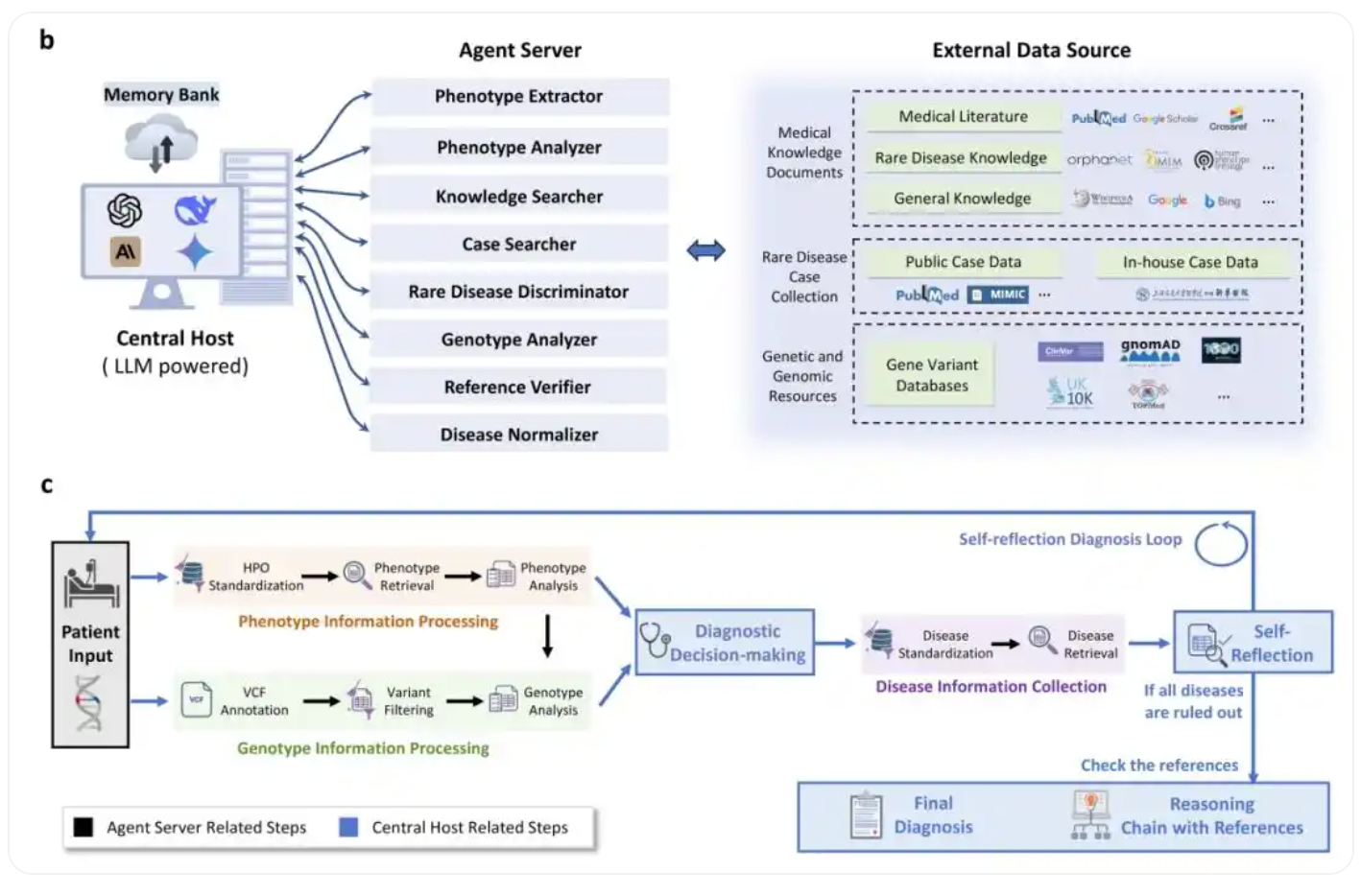
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54






