在刚刚结束的2019年美国临床肿瘤学会(ASCO)年会上,CheckMate 040临床研究的第4队列数据首次证实了纳武利尤单抗(O药)和伊匹木单抗(Y药)联合治疗方案可使晚期肝细胞癌(HCC)患者显著获益。四年前,作为肝癌免疫治疗的经典研究,CheckMate 040初登ASCO舞台,开启了肝癌免疫治疗的新时代。此次,O药+Y药免疫联合治疗的结果公布又将为肝癌免疫治疗增加多少砝码?中国临床肿瘤学会肝癌主委会主任、解放军东部战区总医院全军肿瘤中心主任秦叔逵教授深度解读了此项研究:
CheckMate 040,首证免疫联合疗法对肝癌患者有效且安全
CheckMate 040是一项正在进行中的开放标签、多队列、多中心I/II期临床研究,旨在评估纳武利尤单抗或者以纳武利尤单抗为基础的联合方案治疗晚期HCC患者的疗效,包括原有或无慢性病毒性肝炎、既往未接受过或接受过索拉非尼治疗后不耐受或者病情进展的患者。
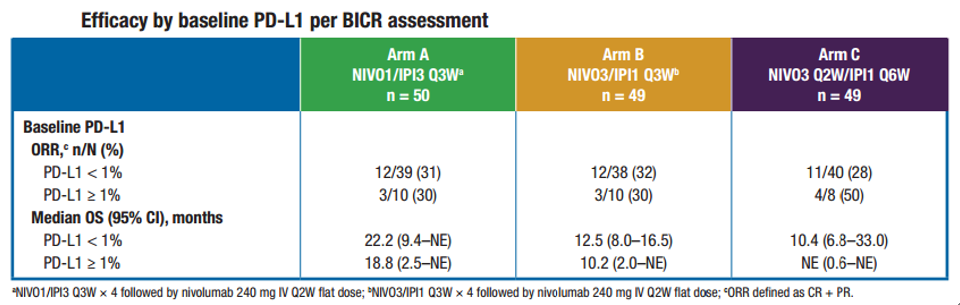
CheckMate 040研究设计共包含6个队列。此次在ASCO大会上发布的是队列4研究结果。其探索性地评估了三种纳武利尤单抗和伊匹木单抗联合给药方案在索拉非尼经治患者中的安全性和有效性[1]。
该研究共纳入148例伴或不伴有HBV/HCV感染的晚期HCC患者,其中146例患者接受过索拉非尼治疗,患者被1:1:1 随机分为三组,接受剂量及时长有所不同的方案:
该研究首次证实,纳武利尤单抗联合伊匹木单抗在晚期肝癌中疗效显著且安全性可控:
1. 三个治疗组患者中均观察到获益:
经过至少28个月的随访,由盲法独立中心审查委员会(BICR)根据RECIST v 1.1标准评估的客观缓解率(ORR)为31%,疾病控制率(DCR)为49%,至数据截止时,中位缓解持续时间(mDoR)为17.5个月。
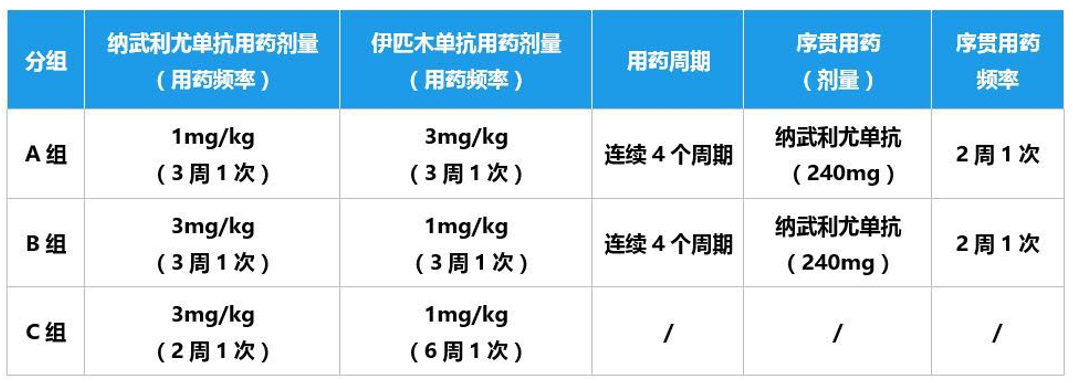
A组、B组和C组的ORR、DCR和mDoR相似,都获得了30%以上的高ORR;DCR分别为54%、43%和49%;mDoR为17.5、22.2和16.6个月。A组患者的中位总生存期(mOS)最长,达到22.8个月,30个月总生存率为44%(图1)。
图1. 总生存数据
2. 多例患者达到深度缓解:
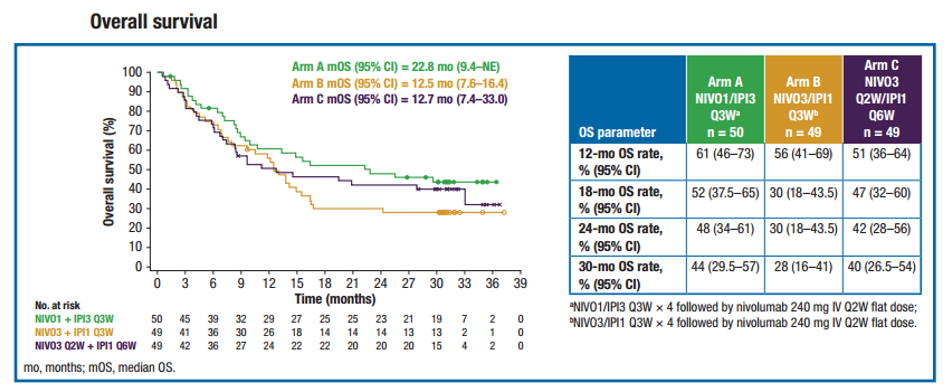
3个组都在多例有治疗应答的患者中观察到深度缓解(图2)。其中,在疾病进展(PD)患者中,A组患者的肿瘤相对增长幅度最小。
图2. 靶病灶缓解程度
3. 获益不受PD-L1表达的限制:
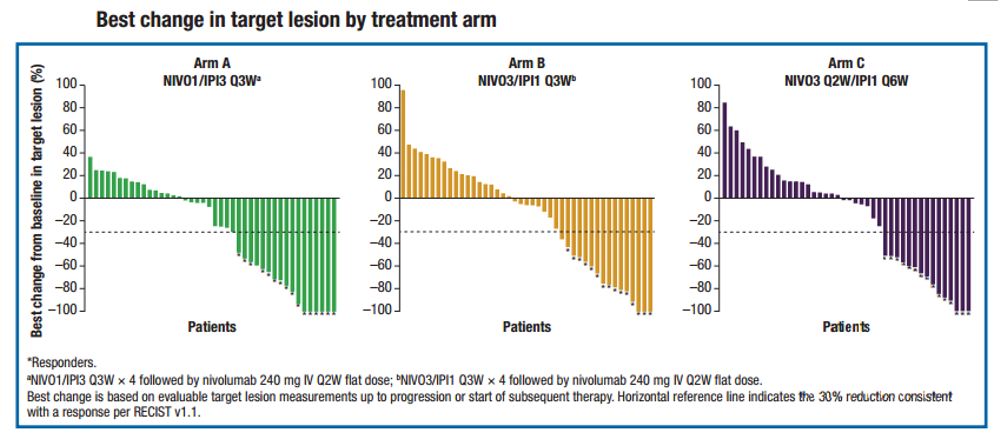
无论肿瘤组织的PD-L1表达水平如何都有显著疗效。在基线PD-L1<1%和PD-L1≥1%的患者中,均观察到ORR和mOS获益(图3)。
图3. 基线PD-L1表达与疗效的关系
4. 安全性可控,没有新增的不良反应:
A组、B组和C组的治疗相关不良事件(TRAEs)发生率分别为94%、71%和79%。最常见的3-4级TRAEs包括瘙痒、皮疹、腹泻、谷草转氨酶升高和脂肪酶升高。整体TRAEs属于可逆可控范围内,均未观察到因增加伊匹木单抗而出现的新的安全性信号,患者耐受性较好。
突破“癌王”僵局 ,疫疗法“纳”入指南
自2015年起,肝癌免疫治疗研究(如CheckMate 040、KEYNOTE-240、KEYNOTE-224以及SHR-1210等临床试验)结果陆续公布,突破了“癌王”肝癌系统治疗的僵局。作为其中最早开展的临床研究,CheckMate 040研究对于推动免疫治疗在肝癌领域中的发展起到了至关重要的作用。
CheckMate 040研究中队列1和队列2是纳武利尤单抗的剂量爬坡与剂量扩展试验。这两项队列的试验结果表明,纳武利尤单抗单药治疗不同疾病原因、不同阶段、不同地区的晚期肝细胞癌患者,均有令人欣喜的表现[2,3]:
1. 显著提高治疗有效率:一线治疗的ORR约为20%,二线ORR在15%左右[2],相比靶向药物治疗(一般为3.3%-7%之间 [4,5,6,7])实现了ORR飞跃性提升;
2. 疗效提高转化为生存获益:纳武利尤单抗一线治疗的中位OS达到28.6个月,二线治疗的mOS达15.6个月[2],从根本上改变了晚期HCC患者生存时间短、疾病进展迅速的局面;
3. 东西方人群疗效相当:纳武利尤单抗在HBV感染比例更高的亚洲人群中的治疗反应和生存率与总人群无异。在入组的二线HCC患者中,包括中国人群在内的亚洲患者占比近50%。数据分析显示,亚洲患者与总人群的两年生存率分别为34.5%和33.6%[3];
4. 乙肝丙肝患者疗效相当:亚洲人群不同病因的患者均能获益[3],解决了“中国特色”难题。对于具有乙肝背景的患者,强调同时全程应用恩替卡韦等抗乙肝病毒药物。
基于以上结果,CheckMate 040打开了PD-1抑制剂治疗晚期HCC的“大门”。在PD-1 抑制剂被国内外临床实践指南广泛推荐作为晚期肝癌二线治疗方案的背景下,纳武利尤单抗基于其在CheckMate 040研究中的一线数据,还被2018年欧洲肿瘤内科学会(ESMO)肝细胞癌的诊断、治疗和随访指南唯一推荐用于HCC的一线治疗。
立足单药、探索联合,一线治疗潜力巨大
免疫肿瘤药物在临床研究中显示出较于既往的标准治疗方案的优势,如具有较长的疗效持续时间和生存时间等,使得业界对免疫疗法的应用前移以及与其他治疗手段的联合寄予厚望。
免疫疗法有望向一线用药进军:针对肿瘤免疫逃逸的治疗是HCC的热点研究方向。在CheckMate 040研究中,免疫疗法在未经索拉非尼治疗患者中的数据,让我们看到了PD-1单抗前移至一线治疗的潜力和机遇。
多模式、多学科、多药物:肝癌的病因特别复杂,为进一步提升肝癌治疗的效果,需要以“组合拳”,即免疫肿瘤药物联合介入治疗、抗血管生成药物、化疗和其他免疫肿瘤药物等是目前临床研究的重点和热点。此外,以MDT多学科团队协作模式为载体的全程管理也将成为肝癌系统治疗的发展趋势。
注:
1. 纳武利尤单抗在中国大陆仅获批用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者;
2. 伊匹木单抗尚未在中国大陆获批上市;
3. 截至目前,尚无免疫肿瘤治疗药物在中国大陆获批肝癌适应症。
参考文献:
1. Thomas Yau, et al. Nivolumab (NIVO) + ipilimumab (IPI) combination therapy in patients (pts) with advanced hepatocellular carcinoma (aHCC): Results from CheckMate -040. Abstract and Poster #4012. Presented at the American Society of Clinical Oncology Annual Meeting; May 31–June 4, 2019; Chicago, IL, USA.
2. El-Khoueiry, A.B., Sangro, B., Yau, T. et al. nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017. Jun 24;389(10088):2492-2502.
3. Hsu C., et al. nivolumab in advanced hepatocellular carcinoma (aHCC): Asian Cohort Analysis from the CheckMate 040 study. Poster presented at 2018 CSCO. 2018 Sep.
4. Kudo, M., Finn, R.S., Qin, S. et, al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018 Mar; 391(10126): 1163-1173.
5. Chen, A.L., Kang, Y.K., Chen, Z. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009 Jan;10(1):25-34.
6. Bruix, J., Qin, S., Merle, P. et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2016 Dec:389(10064):56-66.
7. 秦叔逵,HCC免疫治疗实践的若干重要问题,CSCO第三届全国肿瘤免疫高峰论坛现场讲话,2019年4月.
来源:肿瘤资讯
为你推荐
 资讯
资讯 诺和诺德聚焦零售药店体重管理服务,启动“零售科学减重生态联盟”
1月22日,诺和诺德在福州举办超越·共盈——诺和诺德零售生态伙伴大会,大会汇聚连锁零售药店管理层、临床专家、资深药师、行业智库、零售生态合作伙伴等多方力量,正式启动零...
2026-01-22 21:53
 资讯
资讯 优赫得在华获批治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者
基于DESTINY-Gastric04 III期试验结果,与雷莫西尤单抗+紫杉醇相比,优赫得®可为患者带来具有显著统计学差异和临床意义的总生存期(OS)改善,两年OS率实现翻倍
2026-01-22 17:53
 资讯
资讯 传奇生物CAR-T细胞药物 Carvykti(西达基奥仑赛)2025年销售额18.87 亿美元,同比增长 95.9%
强生2025年全年收入达到941 93亿美元,同比增长6%,净利润268 04亿美元,同比增长90 6%,调整后净利润262 15亿美元,同比增长8 1%。
2026-01-22 16:48
 资讯
资讯 从收费难题到医保立项:机器人诊疗迎来普及拐点
2025年12月5日,国家医保局向各省医保局下发了《手术和治疗辅助操作类医疗服务价格项目立项指南(征求意见稿)》,用于在医保体系内部征求意见。
文/梁瑜 2026-01-21 16:48
 资讯
资讯 英矽智能6600万美元授权一款具有穿透血脑屏障的潜在在研抗炎药物
1月20日,英矽智能发布公告称,与深圳衡泰生物科技有限公司就 ISM8969 项目达成共同开发合作协议。
2026-01-21 15:42
 资讯
资讯 国家医保局规范手术和治疗辅助操作类医疗服务价格,手术机器人有了系统明确收费指引
近日,国家医保局编制印发《手术和治疗辅助操作类医疗服务价格项目立项指南(试行)》,将已有价格项目规范整合为37项,覆盖医学3D重建、生物3D打印、术中显微成像、手术路径导...
2026-01-21 15:12
 资讯
资讯 GSK22亿美元收购间接获得中国创新药资产
1月20日,GSK(葛兰素史克)宣布与RAPT Therapeutics达成最终收购协议,根据协议条款,葛兰素史克将以每股58 00美元的现金价格收购RAPTTherapeutics全部已发行普通股,对应股...
2026-01-21 14:33
 资讯
资讯 182家单位入围2025年人工智能医疗器械创新任务揭榜挂帅,都有哪些项目
近日,工信部办公厅 与国家药监局综合和规划财务司公布2025年人工智能医疗器械创新任务揭榜挂帅入围单位。
2026-01-21 10:32
 资讯
资讯 上海医药iNKT细胞注射液获批临床试验
1月20日,上海医药集团股份有限公司发布公告称,下属上海医药集团生物治疗技术有限公司自主研发的“B023细胞注射液”收到国家药品监督管理局核准签发的《药物临床试验批准通知书...
2026-01-20 16:49
 资讯
资讯 蚂蚁阿福升级PC端,面向医生群体上线 DeepSearch功能
今日,蚂蚁阿福升级其 PC 端,并上线DeepSearch(深度搜索)功能打造中国版“Open Evidence”,免费为医生、医学生及基层医疗工作者等泛医学人士提供专业服务。蚂蚁阿福 PC...
2026-01-20 15:56
 资讯
资讯 可突破血脑屏障,FDA受理非小细胞肺癌创新药上市申请
近日,美国生物医药公司Nuvalent宣布,美国FDA已受理其为zidesamtinib递交的新药申请(NDA)
2026-01-20 11:41
 资讯
资讯 核药创新再破局!远大医药TLX591-CDx国内NDA获受理
远大医药(0512 HK)再度传来核药重大利好——公司用于诊断前列腺癌的创新放射性核素偶联药物(RDC)TLX591-CDx向国家药监局递交的新药上市申请(NDA)已获受理。
2026-01-19 21:29
 资讯
资讯 eCTD验证软件更新V1.1.0版,3月1日起,V1.0版及配套操作手册将不再适用
本次更新内容主要包括新增原料药申请验证规则,调整PDF文件书签、超链接和文件大小验证规则、完善部分文字描述等。
2026-01-19 14:18
 资讯
资讯 阿斯利康获得西比曼靶向GPC3细胞疗法剩余50%的全球权益
1月16日,西比曼生物科技宣布与阿斯利康达成协议,后者将收购西比曼在中国对C-CAR031的开发和商业化权益的50%份额,由此阿斯利康将获得C-CAR031在全球范围内开发、生产和商业化...
2026-01-19 13:19
 资讯
资讯 2025年国民经济数据:16—59岁人口85136万人,占全国人口的比重为60.6%;60岁及以上人口32338万人,占全国人口的23.0%
全年出生人口792万人,人口出生率为5 63‰;死亡人口1131万人,人口死亡率为8 04‰;人口自然增长率为-2 41‰。
2026-01-19 11:41