在刚刚过去的这个夏天里,人工智能再度引爆魔都上海。曾一度野蛮生长的AI医疗,如今也将纳入“编制”,迎来首批AI三类器械审批证。
有专家预测,原本拟定于今年发放的AI医疗三类器械审批证,或将推迟到明年。而最先可能拿到AI三类审批证的几类器械依次为:肺结节筛查、眼底筛查和皮肤病变类筛查器械。
AI三类器械审批“三重门”
中检院大门已敞开
对于AI医疗三类器械审批,相关政策可以追溯到2017年9月,国家食药监总局发布新版《医疗器械分类目录》,规定自2018年8月1日起实施。
按照新《分类目录》规定:诊断软件通过算法提供诊断建议,仅有辅助诊断功能,不直接给出诊断结论,则需申报二类医疗器械;如果对病变部位进行自动识别,并提供明确诊断提示,则按照第三类医疗器械进行管理。
此外,开办第二类医疗器械经营企业需由省、自治区、直辖市人民政府药品监督管理部门备案;第三类医疗器械经营企业,则应当经省、自治区、直辖市人民政府药品监督管理部门审查批准,并发给《医疗器械经营企业许可证》。
《分类目录》规定施行一年有余,以点内科技、图玛深维、推想科技、深睿医疗等为代表的众多AI医疗企业已经获得了二类医疗器械证书。
虽然第一张AI三类器械审批证尚未发出,但相关审批部门及该领域企业都在积极推进AI三类器械的落地。
2018年年底,国家药监局在北京举行了针对该类器材的专项公益培训会,初步拟定AI三类器械审批通过的重点。
2019年2月,国家药监局医疗器械技术审评中心进一步发布《深度学习辅助决策医疗器械软件审评要点(征求意见稿)》并公开征求意见。
2019年5月,北京一家致力于糖尿病视网膜病变人工智能自动筛查的AI三类器械产品,率先通过了中国食品药品检定研究院的测试,进入临床试验阶段。据悉,目前国内多家企业的医疗AI产品已送检,并进入审批通道。
送检中检院是AI三类医疗器械审批流程中的第一关,器械后续还需经过药监部门注册审批,并通过医保局定价。据业内人士估计,后两个流程总计大概需耗时三年半。
针对相对较久的审批流程,国家药监局医疗器械技术审评中心部长贺伟罡认为:“人工智能医疗器械还是一个新兴的领域,具体产品在研发过程中会遇到很多技术难点,需要监管方和企业共同探索。”
AI三类器械审批重点出台
2019年6月28日,国家药品监督管理局医疗器械技术审评中心公布了《深度学习辅助决策医疗器械软件的审评要点及相关说明》(下称“审评要点”),主要包括五个方面:
适用范围、审评关注重点、软件更新、相关技术考量、以及注册申报资料说明。
这是在药监局进行“人工智能类医疗器械注册申报公益培训”半年之后,以文件的方式将审批相关的具体指标确立下来。
审评要点指出,
在需求分析阶段,应当以软件的临床需求与使用风险为导向,而算法性能应当考虑假阴性与假阳性(指标、关系)、重复性与再现性、鲁棒性(即一套系统在异常和危险情况下的生存能力)等要求。
在数据收集阶段,审评要点要求AI器械的数据收集应当考虑数据来源的合规性和多样性、目标疾病流行病学特征、数据质量控制要求;数据来源应当在合规性基础上尽可能来自多家、不同层级的临床机构,以保证数据多样性,提高算法泛化能力;数据收集应当考虑数据采集、数据预处理、数据标注、数据集构建等活动的质控要求,以保证数据质量和算法设计质量。
在算法设计上,则应当考虑算法选择、算法训练、网络安全防护、算法性能评估等活动的质控要求。审评要点建议通过数据驱动与知识驱动相结合进行算法设计,以提升算法的可解释性。
在软件更新方面,审评要点明确软件版本命名规则应涵盖算法驱动型和数据驱动型软件更新,并应列举了重大软件更新的全部典型情况。轻微数据驱动型软件更新可通过质量管理体系控制,无需申请注册变更。
此外,审评要点还明确了非辅助决策软件、传统人工智能软件的要求以及第三方数据库、移动与云计算等考量,但没有包含人工智能伦理、数据产权等法律法规层面要求,仅限于生产企业应在软件全生命周期过程中考虑相关规定。
这份“深度学习辅助决策医疗器械软件的审评要点及相关说明”凝结了此前各方讨论意见,形成了AI医疗三类器械与监管方、企业的最大公约数。政府在审批申报过程中也给予一定优惠政策,比如开通了申报的绿色通道。
据了解,科亚医疗研发的无创CT-FFR深脉分数产品已经进入“创新医疗器械绿色通道”,成为首款进入绿色通道的三类人工智能医疗影像产品。
他山之石 —— AI三类器械的落地之旅
相比于中国,美国在探索新科技的事务中一贯积极,这在AI发展领域尤甚。对于AI医疗器材的审批,FDA打破了传统医械审批政策可能带来的限制:
实施“数字健康创新行动计划”,发布新指导贯彻立法、重构数字健康产品监督体系;
单独组建成立AI与数字医疗审评部;
通过降低医疗AI产品门槛来加快审批速度,比如将一些三类医疗AI产品降为二类产品进行审批。
正因如此,美国医疗AI产品注册审批进度更快,比如:
2018年2月,审批第一个针对中风的AI诊断决策支持产品Viz.AI的ContaCT,以及第一个针对儿童自闭症的AI诊断决策支持系统Cognoa的深度学习应用。
2018年4月初,批准通过了首个应用于一线医疗的自主式人工智能诊断设备——IDx-DR 的软件程序。
目前,FDA对于软件类医疗器械的审批和更新采用“基于风险”的模式,FDA会评估厂商提交的材料是否充分阐明了新软件版本对医疗器械效果具有的潜在影响。
但随着AI技术的发展,这项规定已经显得有些不合时宜——AI的算法使其可以不断利用新获取的数据来更新迭代,而无需通过传统的软件更新。
FDA前任局长Scott Gottlieb博士表示:“如果能解除此类AI更新的限制,医疗器械类软件会有更大的发展空间。但这也要求我们对其有细致的了解,确保这些先进技术的收益大于风险。”
相比于美国十分严苛的AI管理准则,中国监管部门释放出的信息显得更为包容。
中国卫生信息学会健康医疗大数据基层应用专业委员会主任委员许速认为:“只有随着人工智能应用进程的推进,我们的法律规范才能逐渐健全起来,很多问题我们不可能过早发现。在没有道理的时候,我认为我们的方法不要太讲道理。所以应该更多地投入应用、探索,才能在实际过程中形成新的标与规范。”
2019年7月17日,国家药监局医疗器械技术审评中心联合包括中国部委单位,以及清华大学、华西医院,四川大学、301医院,协和医院等14家单位联合成立了人工智能医疗器械创新合作平台,目的在于服务审评审批,帮助产品实现技术创新与转化。
如今,AI医疗三类器械审批程序正稳定推进,但距离三类器械真正落地临床仍需时日。这其中不乏许多难题:基于开源数据的可靠性、AI样本标准以及流程权责等问题均尚待明晰。
不过这也是行业内各方人士正共同致力于解决的问题,相信在不久的未来,中国AI医疗企业将“持证上岗”,在严格监管、合法合规的前提下真正普惠民生。
来源: MedTrend医趋势
为你推荐
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
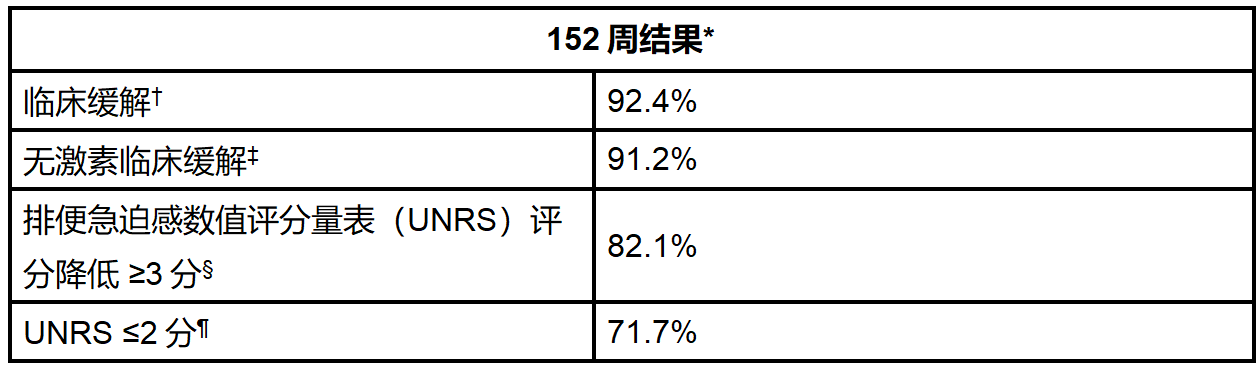
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58









