2015年被业内称为基因测序临床应用的元年。
4月8日,浙江迪安诊断技术股份有限公司(下称“迪安诊断”)发布公告称,其全资子公司杭州迪安医学检验中心有限公司取得了第一批“肿瘤诊断与治疗项目高通量基因测序技术临床应用试点”资格。
“公司将积极研究肿瘤筛查与靶向药物伴随诊断技术等,为肿瘤病人设计个性化治疗方案。”迪安诊断在公告中写道。迪安诊断是一家为各级医疗机构提供医学诊断服务的医学的公司。
与迪安诊断一同获得临床应用试点的基因公司还包括华大基因、达安基因和博奥生物,华大基因是中国规模最大的基因公司,达安基因是上市公司中唯一以基因为主业的公司,博奥生物获得了基因产业的全部试点牌照和产品证书。此外,北京、上海、天津、湖南、广东、浙江等省市的多家医疗机构和第三方检验室入选临床试点。
博奥医学检验所总裁张治位称,“2015年是中国高通量基因测序临床应用真正的元年,对产业发展和行业监管可能具有历史性意义,影响巨大。”
“发放临床试点牌照意味着商业化步伐的临近,”北京知因科技有限公司董事长陆凤林表示:“按照中国生物制药的监管惯例,试点牌照之后即是产品证书,肿瘤基因测序或将成为继无创产前检测(NIPT)之后的又一个基因测序商业化项目。”
东兴证券医药行业分析师宋凯的判断与此类似,“我们预判植入前胚胎遗传学诊断(PGD)和肿瘤将是(基因测序)下一个商业化的领域,如果这些领域或项目能够批产品证书,将成为行业巨大刺激因素。
肿瘤基因测序的细分市场包括癌症超早期筛查、愈后监控、化疗用药指导、风险评估以及基因治疗。
《健康智汇》调查采访发现,癌症超早期基因筛查已于2014年陆续进入市场,但由于数据积累不足、价格偏高等因素,商业化进程的阻力仍然存在;肿瘤愈后监控呈现出刚需的市场前景,但须获得医院的认可;化疗用药指导产品最为成熟,市场竞争激烈;肿瘤基因治疗一直处于研究阶段,世界范围内均未实现突破,商业化路途较为遥远。
临床试点获批:癌症早筛市场启动
癌症早期筛查或许是肿瘤高通量测序最先争夺的市场。
”公司正加大肿瘤基因诊断技术的研发,加快完成各项肿瘤基因的早期筛查与诊断。“迪安诊断在全景网互动平台上向投资者表示。
国家卫计委在癌症早期筛查上也表现出了积极态度。4月10日,国家卫计委疾病预防控制局局长于竞进在例行新闻发布会上透露:“目前正在组织专家研究制定2016-2025年癌症防治中长期规划,对于那些符合成本效益的早期癌症筛查、干预和适宜技术,在科学评估的基础上加大推广力度。”与影像学、标记物等传统的肿瘤筛查手段不同,高通量测序技术将肿瘤筛查深入至DNA层面,据称可以提前数年发现其蛛丝马迹,此类技术被称为“液体活检”。
美国约翰霍普金森大学对癌症分子层面的早期筛查进行了长期研究,其教授福格斯坦做过这样的估算,肿瘤至少含有1000万个细胞、像大头针的头部那么大时,就会释放出可检测到的DNA,相比之下,肿瘤要100倍于这个尺寸,至少包含10亿个细胞,才会在核磁共振检查中显现。
事实上,虽然获得了首批肿瘤测序临床试点资格,但据了解,截至目前,迪安诊断、华大基因、达安基因的癌症早期筛查和诊断产品尚未进入市场,其中,华大基因于2014年启动“万人群肿瘤基线计划”,试图通过比较健康人群与已确诊的肿瘤早期、中晚期人群之间的差异,划分出健康人群和肿瘤患者之间在基因组学指标上的分水岭,但该计划尚未积累足够的数据。
而试点单位中唯一的例外是北京博奥医学检验所。
据悉,博奥生物于2014年4月1日推出了“圆梦谱肿瘤超早期预警”产品,通过检测人体血液中的miRNA以达到提前1-2年发现肿瘤的目的。已有的研究证明,miRNA的异常表达与肿瘤的发生、发展密切相关。“圆梦谱”可以针对非小细胞癌、结直肠癌、食管癌、肝癌、前列腺癌等进行超早期预警。
另一家推出肿瘤超早期预警产品的公司是普世华康江苏医疗技术有限公司(下称“普世华康”),与博奥生物的技术路线稍有差别,普世华康通过检测血液样本中的ctDNA以实现癌症筛查,这项名为PREMID的筛查产品推向市场将近一年时间,已积累了数千例样本。
普世华康公司提供给的产品目录显示,PREMID可检测18种常见肿瘤,并可对肿瘤实现术后、愈后监控。
虽然普世华康尚未进入国家卫计委“肿瘤诊断与治疗项目高通量基因测序技术临床应用试点”名单,但该公司另辟蹊径,于近日获得了澳门卫生部门的准入资格,4月27日,澳门马泷医院获得澳门卫生总署批准设立PREMID肿瘤超早期筛查实验室和门诊。
普世华康董事长对癌症早筛市场颇为看好,”PREMID技术为我们独家拥有,争取2015年销售过亿元。“普世华康董事长王弢表示。
潜在的市场前景以及技术的独特性使得普世华康获得多家投资机构的注资,截至目前,公司获得了苏州官方、通用创投、经纬(中国)等投资机构超过亿元的投资。
在市场需求方面,上述两家公司的判断基本一致,“癌症高危、癌症疑似以及癌症术后的人群存在需求。”
数据不足、价格偏高:早筛商业化阻力仍存
事实上,在国家卫计委公布肿瘤基因测序临床试点单位之前,普世华康和博奥生物的产品已经推向市场,但将近一年的商业化路途并不轻松。
市场推广的最大阻碍来自临床数据的不足,这一点不难理解,临床数据需要在医疗机构中积累,而在国家卫计委公布临床应用试点之前,医疗机构并不具有合法积累数据的身份。
临床数据不足使得产品难以大规模进入医院渠道。
据悉,北京和睦家医院曾拒绝了某癌症早筛项目,理由是公司没有提供足够的临床数据,以证明这一基因筛查项目的精确性。
约翰霍普金森大学研究人员威尔克斯库认为,血液检测的意义在于”极其准确“,如果检测出你的血液中出现肿瘤DNA,则说明你目前已经患有癌症。斯坦福大学外科肿瘤研究所所长斯特芬妮。杰夫睿的看法与此类似。
为了佐证液体活检的准确性和漏检率,普世华康与平安保险公司签订了承保协议,”如果检测出某位消费者携带肿瘤DNA,那么他可以去医院进行确诊,以验证我们的准确性;如果没有检测出肿瘤DNA,消费者在一定时期内却查出自己患有癌症,平安保险会理赔15万-20万,附带每天180元的住院补贴。“王弢对《健康智汇》表示。
事实上,争取到保险公司对产品的承保出于无奈之举,因为国内的医院暂时难以帮助企业完成临床数据的积累。
由于医院渠道阻碍,目前,普世华康和博奥生物癌症早筛项目的主要渠道集中于体检中心、健康管理中心、企业集团等。
不过,随着国家卫计委对肿瘤测序临床试点的放开,数据积累的瓶颈有望打破。按照国家卫计委公布的第一批临床试点名单,北京、天津、上海、湖南、浙江、广东的20家医院或医学检验所可以实现临床数据积累。
制约癌症早筛市场的第二个因素是价格。
《健康智汇》从普世华康和博奥生物了解到,两家公司的肿瘤早筛价格在数千元到2万元之间,并且尚未纳入医保报销。这一价格决定了癌症早期筛查主要面对中高端、对健康较为关注的人群。
价格较高的原因是仪器和试剂费用。据悉,国内目前尚无法生产基因测序仪,只能向国外公司购买,价格在500万美元左右;而试剂的研发制造成本也居高不下,与其他医疗器械和药品相比,试剂的成本占据较大份额。
此外,基因测序结果的解读需要高层次的生物工程人才,人力成本也不低。
肿瘤愈后监控:一个可能被忽略的刚需市场
“与肿瘤早筛相比,肿瘤愈后监控似乎没有得到足够的重视,”北京知因科技董事长陆凤林对《健康智汇》表示:“国家卫计委放开临床试点后,愈后监控或许会是个更大的市场。”北京知因科技公司是一家从事肿瘤基因测序及检测仪器的代理公司。
《健康智汇》发现,普世华康和博奥生物更加重视早筛产品的推广,而愈后监控产品的宣传力度远没有早筛产品大。
事实上,在欧美国家,分子层面的肿瘤愈后监控产品早于肿瘤早期筛查。
据悉,美国的Personal Genome Diagnostics、Boreal Genonics和Guardant Health三家公司可提供液体活检服务,但是仅面对癌症中晚期患者。对于这些患者而言,血液检测可揭示治疗是否有效,如果无效则尝试其他的治疗方法。
出于医学及商业上的考虑,Guardant公司只针对癌症晚期患者,虽然其掌握的技术可以进行癌症早期筛查。
约翰霍普金森教授福格斯坦曾撰文称,对于一个癌症患者,他不介意花费5000美元做基因检测,而对于一个健康人,可能不愿意每年花费1000美金做体检。
普世华康肿瘤愈后监控产品可通过对血液或者肿瘤组织的检测,评估病患的复发危险程度。其实,这是一个比早期筛查需求更加”刚性“的领域,其价格也普遍低于早期筛查。
但获取癌症病源的途径以医院为主,而医院的接纳程度限制了这一刚性市场在中国的扩展。
“在国家卫计委放行临床试点之前,医院不具有临床应用的合法身份,”陆凤林说:“此外,医生似乎也不愿意找出一种方法来验证自己治疗的效果。”
癌症精准治疗:停留于研究阶段
3月26日,科技部召开了中国首届精准医疗战略专家会议,计划在2030年前总计投入600亿元支持资金,这一政策与肿瘤基因测序具有高度关联。
“最近精准医疗比较热,与基因组学的技术进步有很大关系,在肿瘤领域,基因测序可以帮助患者选择化疗药物,每个人的基因表达不同,用药也不同。”天坛医院神经外科主任医师肖新如对《健康智汇》表示:“精准医疗最主要的作用是提高治疗效率、减少副作用、减少经济负担。”肖新如提及的化疗药物选择产品称为化疗用药指导,目前这一基因检测已成为肿瘤治疗过程中的必检项目,市场较为成熟,价格在数百到千元之间。
但这并非是真正意义上的基因治疗,后者是指外源正常基因导入靶细胞,纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的。
基因治疗在美股的上市标的包括BLUE、QURE、CLDN、AGTC 和AAVL,但尚未出现用于肿瘤治疗的产品,中国在此方面也处于实验室研究阶段。
肖新如曾在日本研究胶质瘤的基因治疗方法,其原理是通过病毒载体把一种抗肿瘤血管生成的药物导入人体,从而抑制肿瘤生长。
然而,由于肿瘤的复杂性,基因疗法没有明显突破。”肿瘤的生长是由很多基因共同作用而成,阻止了其中一个,在短时间可以起效,但经过一段时间后,肿瘤细胞自己会发生改变,半年到一年之后可能会复发。这相当于阻断了一条通路,肿瘤又开辟了另一条通路。“肖新如解释称。
“肿瘤的复杂性决定了基因疗法将在一个较长的时期内处于研究阶段,”肖新如说:“中国现在需要做的是鼓励临床实践。”
来源:健康智汇
为你推荐
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
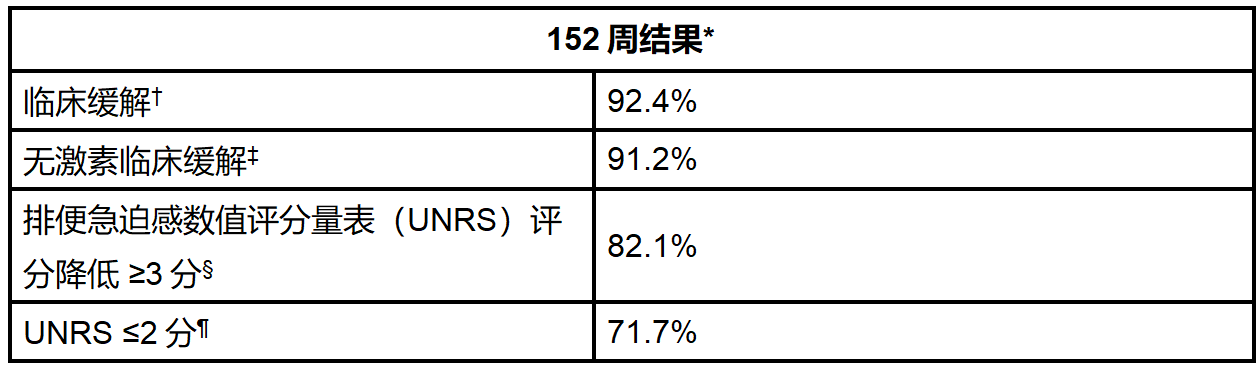
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42





