日前,日本药企盐野义制药的一款新冠口服药物因号称其治愈率达到100%,引发业内强烈关注。
真有那么神?
近日,盐野义制药宣布,该公司研发的治疗新冠病毒的口服药S-217622(内部研发编号),已向日本厚生劳动省申请生产销售许可申请,如若该药物获得日本相关监管部门的批准, 其将成为日本首款国产研发生产的新冠特效药,此前,默沙东的Molnupiravir和辉瑞的Paxlovid已相继在日本获得附条件批准。
据了解,S-217622由盐野义制药联手北海道大学共同研究开发,是一款3CL蛋白酶抑制剂。3CL蛋白酶(又称为主蛋白酶)是在病毒自身编码中剪切和加工RNA的蛋白酶,其抑制作用可阻止复制必需酶的形成,如RNA依赖性RNA聚合酶,从而抑制病毒复制。
2021年7月,盐野义制药公司就开展了S-217622Ⅰ期临床试验,同年9月,开展Ⅱ/Ⅲ期临床试验,S-217622的临床试验主要针对轻症/中症患者。
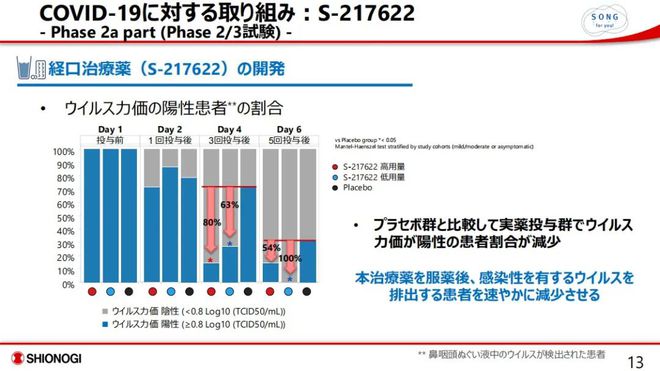
援引中国新闻周刊的报道,盐野义制药日前相继公布了Ⅱ/Ⅲ期临床试验的Ⅱa和Ⅱb期试验结果。从Ⅱa期的实验数据来看,与安慰剂组相比,显著降低病毒滴度及RNA;连续服药3天后(第4日),病毒滴度阳性比例分别下降63%(低剂量组)、80%(高剂量组);病毒滴度转阴的中位时间缩短了2天。在疗效方面,所有服用S-217622的患者均未发展成需要住院的程度,而安慰剂组有14.3%(2/14)的患者需要入院治疗。
S-217622的2a期临床试验结果
值得注意的是,据国金证券研报显示的Ⅱa期抗病毒和安全结果,第6天核酸检测时,服用低剂量S-217622的患者检测结果全部呈阴性(<0.8 Log10 ( TCID50/mL ) ),病毒阳性患者下降幅度达100%,而这也正是“治愈率100%”这一说法的来源。
Ⅱb期试验则进一步扩大了对象和观察范围,已有428名志愿者参与,且主要为奥密克戎毒株感染。盐野义制药宣称,服用S-217622的第四天,阳性患者比例低于10%,与对照组相比,降幅好于2a期,且患者因感染产生的鼻塞、流鼻涕、喉咙痛、咳嗽、呼吸困难等症状都得到了显著改善
对于S-217622 “治愈率100%”这一说法,中国新闻周刊采访的国内一位病毒学家表示:“这一说法并不靠谱,现在的感染者大多是轻症,甚至无症状,所谓的“100%”到底指的是什么,还有待界定。”该病毒学家还进一步解释,“现在很多患者即使不吃药,第五天也测不出病毒,那是不是可以说,喝自来水也会有100%治愈率呢?”
还有医学人士指出:“样本量少,没有更多有说服力的证据,认定一个药品是否对一种疾病有治疗作用,还需要大样本多中心的随机双盲试验,而前述试验之中只有区区几百人,因此无法达到大样本的概念。”
虽然S-217622还有待更大样本、更多的临床试验数据来验证,但盐野义制药提前对S-217622进行了商业化生产,预计4月起能实现1000万人份/年的产能。
另值得注意的是,作为日本第五大制药企业的盐野义制药背后还有一家中国企业,2020年3月,中国平安与盐野义制药"达成战略合作协议,盐野义制药向中国平安旗下中国平安人寿出售库存股635.6万股,交易总额为335.3亿日元(约合21.8亿人民币)。交易完成后,平安人寿合计持有盐野义制药2%的股份,成为盐野义制药第七大股东。
与此同时,双方还计划在在中国香港成立合资公司,该合资公司计划初期聚焦于中枢神经系统的新药疗法,将获得盐野义制药旗下两款新药在亚洲地区(除日本外)的独家代理权,该合资公司还将开展新药研发、制造及销售等多方面业务。
其他新冠口服药最新进展
继5家中国药企获得默沙东新冠口服药Molnupiravir的相关授权后,日前,包括复星医药、华海药业等中国药企获得了日内瓦药品专利池组织(MPP)授权生产辉瑞新冠口服药Paxlovid成分之一奈玛特韦(nirmatrelvir)原料药和/或制剂。
根据华海药业和复星医药发布的公告披露,此次获许可区域为印度尼西亚、越南、巴基斯坦、科特迪瓦等95个中低收入国家,但不包括中国。
本次许可旨在帮助95个中低收入国家可负担地获取许可产品,相关定价预计将低于原研产品或在其他中高收入国家的售价。
关于专利许可费,根据购买方性质的不同,获得授权的企业应按照年度净销售额(定义依据协议) 的5%或10%向辉瑞支付专利许可使用费。基于 Pfizer-MPP 协议,前述专利许可使用费将自 WHO 宣布 COVID-19不再被列为“国际关注的突发公共卫生事件”的次月起开 始收取。但在低收入国家的销售,将豁免向辉瑞支付专利许可使用费。
值得一提的是,3月17日,2.12万盒Paxlovid已经上海外高桥保税区海关验放后,办结全部进口通关手续,火速运往全国抗疫一线,这也是该药物被纳入最新版新冠肺炎诊疗方案后全国的首批进口。
国产新冠口服药方面,进展较快的VV116(由多家研究机构联手旺山旺水生物医药和君实生物共同研发)日前在药学领域知名期刊Acta Pharmaceutica Sinica发表了3项I期临床数据,结果显示,研究结果显示,VV116在健康受试者中表现出令人满意的安全性和耐受性,且口服吸收迅速,可在空腹或普通饮食条件下口服用药,建议在后续临床研究中探索每日两次200毫克至600毫克给药剂量,这是国产口服小分子抗SARS-CoV-2药物首次公布I期临床数据。此前,VV116已在乌兹别克斯坦获得批准用于中重度新型冠状病毒肺炎患者的治疗。
基于I期研究的结果,关于VV116的一项针对轻中度COVID-19患者的国际多中心、双盲、随机、安慰剂对照、II/III期临床研究已启动,另一项在中重度COVID-19患者中评价VV116有效性和安全性的国际多中心、随机、双盲、对照III期临床研究正在进行中。
此外,华创研究研报显示,真实生物的“阿兹夫定(口服)”处于临床Ⅲ期阶段;歌礼制药、先声药业、众生药业等公司的口服3CL抑制剂处于临床前研究阶段,有望在未来6个月陆续进入临床。
来源:医谷网
为你推荐
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
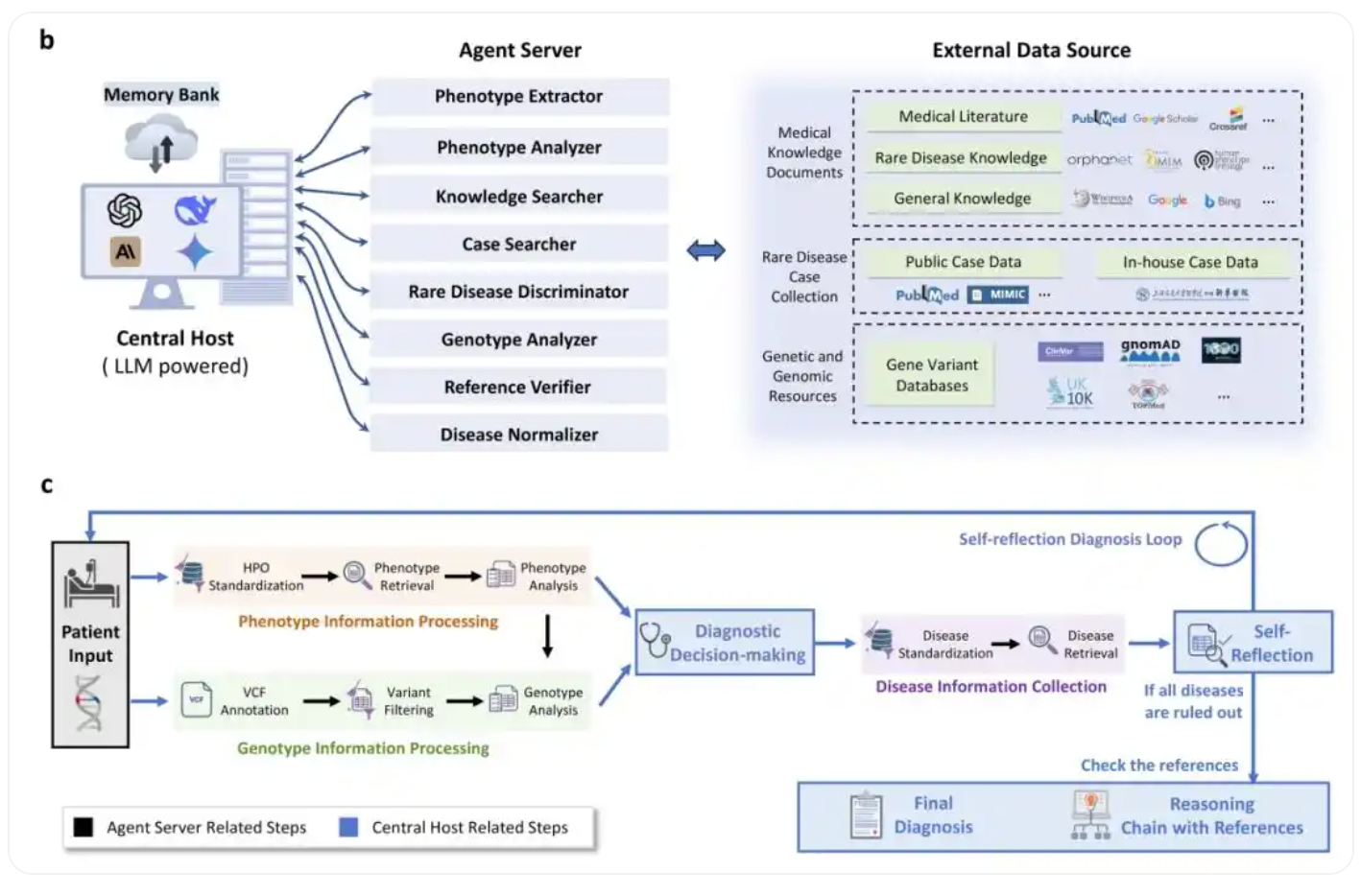
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42
 资讯
资讯 礼来ACHIEVE-3完整数据公布:orforglipron在头对头研究中优于口服司美格鲁肽
2026年2月26日,礼来正式公布了ACHIEVE-3研究的完整数据。该研究结果同步发表于国际权威医学期刊《柳叶刀》。
2026-02-27 11:38
 资讯
资讯 诺和诺德大幅下调司美格鲁肽价格
近日,诺和诺德宣布,将将大幅下调美国的司美格鲁肽药物官方标价(批发采购成本)其中减重版司美格鲁肽Wegovy降幅度50%,降糖版Ozempic降幅约35%。
2026-02-26 13:37
 资讯
资讯 新版《鼓励进口服务目录》发布,生命健康领域有哪些?
2月25日,商务部等七部门联合发布新版《鼓励进口服务目录》,目录主要包含研发设计服务、节能环保服务、环境服务、咨询服务、其他专业服务和医疗与健康服务六大板块。
2026-02-26 11:29
 资讯
资讯 长春高新一项拟用于改善特发性原因导致儿童小阴茎的临床试验获批
2月24日晚间,长春高新(000661 SZ) 发布公告称,旗下核心子公司金赛药业自主研发的GenSci141软膏(双氢睾酮软膏) 正式获得国家药监局临床试验批准通知书。
2026-02-25 22:32
 资讯
资讯 “童颜针”预灌装剂型获批
2月24日,国家药监局发布医疗器械批准证明文件送达信息显示,上海汇悦妍生物科技有限公司全资子公司和妍(上海)医疗器械有限公司申报的“注射用聚左旋乳酸微球填充剂”成功获得...
2026-02-25 14:03
 资讯
资讯 CDE:新药全球同步研发中基于多区域临床试验数据进行获益-风险评估的指导原则(试行)
前是中国审评机构评价MRCT所遵循的主要依据。中国审评机构鼓励申办者基于ICH E17指导原则开展MRCT,加速全球新药在中国市场的同步研发进程,并促进全球新药在中国的同步申报、...
2026-02-25 10:59
 资讯
资讯 李强主持召开国务院常务会议,研究推进银发经济和养老服务发展有关工作
会议指出,我国银发经济潜力很大,要完善支持举措、强化政策落实,促进养老事业和养老产业发展,为应对人口老龄化提供有力支撑。
2026-02-25 10:09
 资讯
资讯 基石药业PD-1在英国获批新适应症
2月24日,基石药业发布公告称,公司PD-1产品舒格利单抗的新适应症申请已获英国MHRA批准,单药用于治疗肿瘤细胞PD-L1表达≥1%、无表皮生长因子受体(EGFR)敏感突变或ALK、ROS1基...
2026-02-24 16:47
 资讯
资讯 9.5亿美元里程碑付款,前沿生物两款小核酸药物授权GSK
2月23日晚间,前沿生物发布公告称,已与全球领先生物制药企业葛兰素史克(GSK)签署独家授权许可协议,葛兰素史克将获得两款小核酸(siRNA)管线产品在全球范围内的独家开发、生...
2026-02-24 13:49