12月22日,美国食品药品监督管理局(FDA)官网显示,其授予辉瑞口服新冠治疗药物Paxlovid的紧急使用授权(EUA),用于治疗患新冠轻症至中症的成人和12岁及以上儿童(体重至少40公斤或约88磅),以及具有较高重症风险的人群。这是FDA授权的首款口服新冠病毒治疗药物。这也是继默沙东Molnupiravir之后,全球面世的第二款口服新冠病毒治疗药物。
可降低88%的住院及死亡风险
Paxlovid是3CL蛋白酶抑制剂PF-07321332(nirmatrelvir)与低剂量利托那韦(ritonavir)的复方制剂。PF-07321332通过抑制3CL蛋白酶的活性,阻断病毒的复制过程。利托那韦有助于减缓PF-07321332的代谢或分解,使其在体内有效浓度维持较长时间,以保持其抗病毒活性。治疗时服用三片药,即两片nirmatrelvir和一片ritonavir,每天口服两次,持续5天,且不能连续使用超过5天。
本次Paxlovid获EUA主要是基于一项随机、双盲、双臂的EPIC-HR研究(NCT04960202)的积极结果,该试验纳入了18岁及以上确诊为COVID-19的未住院成年患者,他们有疾病加重的风险。该试验数据显示,与安慰剂相比,在症状出现的3天内,接受Paxlovid治疗的患者,其住院或死亡的风险降低了88%,治疗组没有死亡病例。在症状出现的5天内也观察到类似的结果。到第28天,Paxlovid组有0.8%(8/1039)的患者住院,而安慰剂组有6%(66/1046)的患者住院。
FDA提示,Paxlovid的可能副作用包括味觉受损,腹泻,高血压和肌肉酸痛。Paxlovid与某些其他药物同时使用时可能会导致潜在的药物相互作用,应谨慎使用。Paxlovid未被授权用于COVID-19的暴露前或暴露后预防,或用于对因严重或危重COVID-19而需要住院治疗的患者治疗。
据12月14日辉瑞表示,口服药似乎对奥密克戎毒株有效,不过还需要更多研究来证实。
此前,英国药品与保健品管理局(MHRA)于2021年11月4日率先批准默沙东和Ridgeback共同开发的新冠口服药物Molnupiravir(商品名:Lagevrio)上市,用于治疗轻至中度的COVID-19成人患者,这是全球面世的首款抗新冠口服药物。
临床数据显示,775名最近感染了新冠病毒的患者接受了Molnupiravir或安慰剂治疗。molnupiravir组有7.3%的患者住院,没有患者死亡;安慰剂组有14.1%住院治疗,有8人死亡,p=0.0012。相比于安慰剂组,molnupiravir治疗组的住院和死亡风险降低了50%。
另据11月26日默沙东和Ridgeback公布的针对所有受试者(n=1433)的完整分析数据显示,molnupiravir将住院或死亡风险降低了30%(HR:0.70)。
此外,值得注意的是,Paxlovid和Molnupiravir均为处方药,应在诊断出COVID-19后和症状发作后五天内尽快开始使用。
一个疗程至少花费529美元
据辉瑞公司(Pfizer)11月18日发布公告称,美国政府已经以52.9亿美元的价格订购了1000万疗程的口服抗新冠病毒药物Paxlovid,前提是该药物已获监管机构批准。这意味着Paxlovid一个疗程至少需要花费529美元(约3378元人民币)。
辉瑞曾预计,到月底将生产18万个疗程的Paxlovid,到2022年底将生产至少5000万个疗程。
此外,辉瑞还表示其已经与数个国家签订了预采购协议,同时也与全球约100个国家启动了双边接触。除此之外,还与联合国支持的MPP(药品专利池)签订一份转授权协议,获得MPP授权的合格仿制药生产商将能向95个国家(其中包括中低收入国家)以零授权费提供其仿制药。
据悉,今年6月,默沙东与美国政府签订协议,一旦获得FDA的紧急使用授权或者正式批准,将向美国政府提供170万疗程的molnupiravir药物,价值12亿美元(约77亿人民币),之后又以总金额22亿美元继续增加至330万疗程。由此估算,molnupiravir平均每疗程至少花费约709美元(约4527元人民币)。同时,包括新西兰、澳大利亚和韩国等亚太地区至少8个国家或地区,已签署协议或正在谈判采购。其中,澳大利亚确认购买30万个疗程。
默沙东及其合作伙伴Ridgeback此前还声明,已经与联合国达成一项治疗许可协议,将在全球105个中低收入国家放弃专利,允许其生产仿制药。
来源:医谷网
为你推荐
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
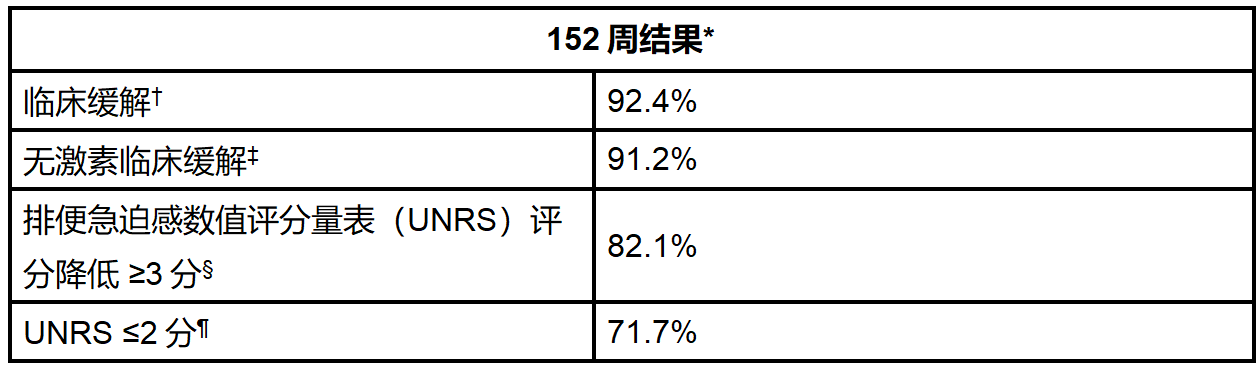
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58










