ADC药物主要应用于抗肿瘤领域,是近年来热门的研究方向之一。
ADC由单克隆抗体(mAb)、偶联链(linker)和细胞毒性小分子(cytotoxin/payload)三部分组成,通过单克隆抗体与肿瘤细胞表面的特异性抗原结合,将细胞毒药物定向递送到肿瘤病灶,对比传统的化药和生物药,明显提升了安全性和有效性。ADC领域在近10年来取得了长足的发展,治疗窗口不断扩大,根据Evaluate Pharma和BCG的预测,全球ADC市场预计2024年将达到129亿美元,2018至2024年的年复合增长率约为35%。
国外ADC药物及市场分析
近一年,国外抗体偶联药物(ADCs)赛道热点不断,先是吉利德以108%的溢价、总值210亿美元收购了ADC公司Immunomedics,引发了不亚于当年119亿美元收购KITE的业内高度关注,辉瑞把两款ADC候选产品转手给了Pyxis。
目前,全球共有11个ADC药物获批,包括Mylotarg(辉瑞)、Adcetris(Seattle Genetics/武田)、Kadcyla(罗氏)、Besponsa(辉瑞)、Lumoxiti(阿斯利康)、Polivy(罗氏)、Padcev(Seattle Genetics/安斯泰来/默沙东)、Enhertu(阿斯利康/第一三共)、Trodelvy(Immunomedics)、Blenrep(GSK)、Akalux(Rakuten Aspyrian)。
从已上市药品的研发企业看,基本是辉瑞、Seattle Genetics、罗氏及阿斯利康四家各有2款,其他3家公司各1款。
辉瑞的Mylotarg是最早获批的ADC药物,2000年5月FDA批准其用于治疗首次复发的CD33阳性急性髓系白血病(AML)的60岁以上患者,不过基于后期Mylotarg未显示出明显的临床益处并存在一定的安全问题,2010年辉瑞将Mylotarg退市直到2017年9月才在再次在美国上市,2020年6月该药扩大适应症至年龄≥1个月、新诊断的CD33阳性AML患者。
Kadcyla和Adcetris则逐渐成长为“重磅炸弹”药物,在2019年双双突破10亿美元关卡,分别达到10.81亿美元和15.72亿美元。Kadcyla已成为HER2阳性乳腺癌在国际上的二线标准治疗方案,2019年5月Kadcyla还被FDA批准为HER2阳性早期乳腺癌患者的辅助治疗方案,市场空间进一步扩容。目前这2款药已分别于2020年1月和5月在中国获批上市,其中Kadcyla(赫塞莱)已纳入2020年医保目录。
作为第三代ADC,Enhertu和Trodelvy势头强劲。2019年12月获批的Enhertu适应症为HER2阳性乳腺癌,鉴于其庞大的患者群体,该药市场前景巨大,同时,今年1月,Enhertu进一步扩大适应症,FDA批准其用于治疗HER2阳性的局部晚期或转移性胃癌和胃食管结合部腺癌患者。根据阿斯利康的年报,Enhertu将成为乳腺癌新晋标准方案,首年销售额2亿美元。
2020年5月获批的Trodelvy则是全球首个TROP-2靶向抗体-药物偶联疗法,也是Immunomedics成立37 年以来上市的首款药物,而该药在上市的头两个月就达到了2010万美元得净销售额。SGEN曾试图以20亿美元收购Immunomedics但未果,最终让吉利德入手。2020年9月吉利德以108%的溢价、总值210亿美元收购了Immunomedics,也将Trodelvy一并收入囊中。行业分析人士此前表示Trodelvy上市后的销售峰值预计将达到10亿美元以上,吉利德的买买买战略为其在ADC盘子里谋得了一块大蛋糕。
此外,其他近几年上市的几款ADC药物均未实现放量,不过据科睿唯安预测,到2024年将有多款年销售额突破10亿美元,包括Polivy和Enhertu等。
除了已上市的11款ADC,据ClinicalTrials.gov的数据显示,截止今年3月19日全球共有155项ADC药物临床试验正在进行,且还在不断增长,同时,各大巨头们也通过买买买不断得扩充自己得ADC管线。2020年11月默沙东以27.5亿美元收购了VelosBio,12月勃林格殷格翰以11.8亿欧元收购了NBE Therapeutics,此外Sterling宣布计划在2021第一季度全面收购英国的ADC Biotechnology。
国内主要的 ADC 药物及研发企业
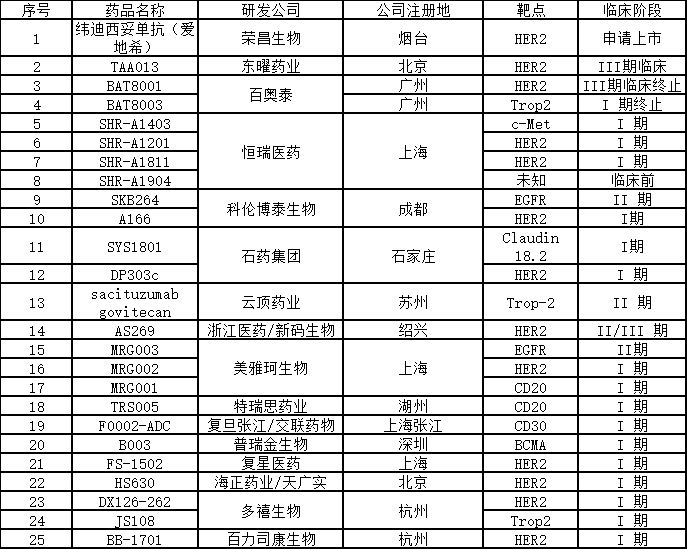
在中国,得益于国内的创新药研发水平不断提升,国内企业在 ADC 药物研发上也迅速跟进。其中荣昌生物的 HER2 ADC 药物 RC48 已经获得国家药监局上市申请正式受理,是国内进展最快的自主研发 ADC 药物;此外有二十多种处于不同阶段临床试验中的ADC药物正在开发中,包括东曜药业、恒瑞医药、科伦药业、云顶新耀、百奥泰、浙江医药等多个公司有产品已经进入临床阶段。除了大多数针对HER2靶点外,其他靶点包括c-Met、EGFR、Trop-2、CD20、BCMA等。
国内ADC药物研发情况 医谷制表
荣昌生物 纬迪西妥单抗
纬迪西妥单抗(商品名:爱地希®,研究代号:RC48)由荣昌生物研发,是国内首个提交新药上市申请的自主开发的抗体-药物偶联(ADC)药物。它以肿瘤表面的HER2蛋白为靶点,能精准识别癌细胞并与之结合,穿透细胞膜进入其内部,从而杀死癌细胞。该药于2015年成为首个获批进入临床研究的ADC药物。2020年8月27日,国家药监局已正式受理该药用于治疗局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的新药上市申请,并纳入优先审评审批程序,受理号:CXSS2000044国。此外,维迪西妥单抗(RC48)还于2020年9月获美国FDA突破性疗法认定用于治疗尿路上皮癌。
东曜药业TAA013
TAA013是由东曜药业研发的一种含有曲妥珠单抗和美坦新衍生物(曲妥珠-MCC-DM1)的在研ADC药物。该药借助曲妥珠单抗的靶向性,与肿瘤细胞膜上的特异性抗原结合,诱发胞吞作用,使高活性细胞毒性药物DM1进入细胞,进而诱发细胞凋亡,用于治疗HER2阳性乳腺癌患者。
目前TAA013 III期临床研究正在进行中,这是一项多中心、随机、平行对照、开放标签研究,针对经曲妥珠单抗治疗失败的、不可切除的局部晚期或转移性HER2阳性乳腺癌患者,对比拉帕替尼联合卡培他滨的有效性和安全性,从而进一步验证TAA013的有效性和安全性。
百奥泰 BAT8001
BAT8001是百奥泰自主开发的一款靶向HER2的ADC药物。该药由抗 HER2 单克隆抗体通过稳定的硫醚键与毒素-连接子 Batansine(一种美登素衍生物)进行共价连接而成。BAT8001 结合到 HER2 受体的第Ⅳ小区后, 开始以受体介导进行细胞内化,之后的溶酶体降解过程导致在细胞内释放含有半胱氨酸-Batansine 的细胞毒性代谢物。 半胱氨酸-Batansine 结合到微管蛋白的过程会破坏细胞内的微管网络,引起细胞周期阻滞与细胞凋亡。
2021年2月8日晚间,百奥泰生物制药股份有限公司(简称“百奥泰”或“公司”)披露抗肿瘤新药BAT8001临床试验进展,BAT8001三期临床主要疗效指标无进展生存期(PFS)与阳性对照组拉帕替尼联合卡培他滨比较未达到预设的优效目标,公司决定终止该项目的临床试验,该项目累计研发投入2.26亿元已计入损益。此外,今年3月初,百奥泰宣布放弃其ADC药物BAT8003和单抗BAT1306的临床开发。据百奥泰公布的2020年报计算,三款药物让百奥泰损失研发投入费用3.4亿元。
恒瑞医药 SHR-A1811
恒瑞医药作为国内创新药研发龙头企业,在 ADC 领域也有很深的布局。目前公司靶向 c-MET 的 ADC 药物 SHR-A1403,以及靶向 HER2 的 SHR-A1201 和 SHR-A1811 都处于临床阶段。今年1月,恒瑞医药第四款ADC药物SHR-A1904的临床实验申请也获得NMPA受理。
注射用SHR-A1811是恒瑞医药自主研发的以HER2为靶点的抗体药物偶联物(ADC),它可与HER2表达细胞的细胞膜表面相结合,然后内吞入细胞到达溶酶体释放小分子毒素,最终诱导肿瘤细胞凋亡,兼具了抗体的高度靶向性以及细胞毒药物对靶细胞的强大杀伤力。
科伦药业 SKB264
2020年4月8日,CDE 官网显示,四川科伦博泰生物医药股份有限公司的 1 类新药注射用 SKB264获临床默示许可,拟用于实体瘤的治疗。注射用 SKB264是靶向人滋养层细胞表面抗原 2(TROP-2)的 ADC 药物,在多种上皮来源肿瘤中高表达,其偶联方式和毒素小分子具有自主知识产权,拟用于恶性肿瘤治疗。注射用 SKB264通过新型偶联方式实现高毒素负载,工艺稳定可控、易于放大,产品批间一致性好。今年8月23日,科伦药业控股子公司KLUS PHARMA INC收到FDA签发的书面通知,允许其“注射用SKB264”抗体偶联药物(ADC)在美开展临床试验。截至目前科伦药业在该药上已投入约2500万元研发费用。
此外,科伦药业ADC药物还有靶向HER2的A166,已向 CDE 提交关键Ⅱ期申请;靶向Claudin 18.2的ADC药物将在2021年进入临床。
石药集团 SYS1801
石药集团自主研发的Claudin 18.2靶向ADC药物SYS1801是国内药企首个Claudin 18.2靶向的ADC药物,2020年11月26日,该药用于治疗胃癌(包括胃食管交界处癌)的适应症获得FDA 孤儿药资格认定。石药集团也计划今年递交中国、美国的临床试验申请。
此外,2019年7月25日,石药集团重组人源化抗HER2单抗-MMAE偶联药物注射液(DP303c)获批临床,适应症为:晚期Her2阳性乳腺癌。
美雅珂生物 MRG003
该公司目前有三个自主研发的创新ADC药物MRG003、MRG002、MRG001已获得NMPA的临床批件,三个I期临床研究正在进行中。
多禧生物 DX126-262
该公司研发的新一代ADC药物DX126-262(DAC-001)已获得国家药监局的临床试验 批件,治疗Her2乳腺癌、胃癌。美国临床申报正在进行中。
浙江特瑞思 TRS005
特瑞思自主研发的ADC药物TRS005用于复发难治型非霍奇金氏淋巴瘤,2018年5月,注射用TRS005获得临床批件,并已启动Ⅰ期临床研究。拟用于复发难治型非霍奇金氏淋巴瘤。
TRS005为国家1类创新药物,该品种已获国家十二五、十三五“重大新药创制”专项滚动支持,并已申请三项中国专利和一项PCT国际专利。TRS005在临床前动物肿瘤模型中展现了十分出色的肿瘤 抑制作用,疗效是重磅级单抗药物 的8倍以上,同时在相对剂量使用上拥有较好的安全性,极具应用前景。
无论国内还是国外,ADC药物研发赛道火热,其市场空间庞大。据中金公司发布的研究报告,整个ADC药物市场有望超过500亿美元。谁能在这一赛道拔得头筹,拭目以待。
来源:医谷网
为你推荐
 资讯
资讯 天津市互联网诊疗监管实施办法(试行)
医疗机构应当主动与市级监管平台对接,及时上传、更新《医疗机构执业许可证》等相关执业信息,主动接受监督。医疗机构取得《医疗机构执业许可证》后或《医疗机构执业许可证》变...
2026-02-06 08:59
 资讯
资讯 八部委发布《中药工业高质量发展实施方案(2026—2030年)》
培育60个高标准中药原料生产基地。协同体系更加健全,中药材种植加工、中药研发生产、流通服务等上下游各环节协同更加紧密,建设5个中药工业守正创新中心,推动一批中药创新药获...
2026-02-05 21:21
 资讯
资讯 国家医保局今年将重点对精神类定点医疗机构开展专项飞检
各省级医保部门要组织本辖区内所有精神类定点医疗机构从即日起全面开展自查自纠,重点聚焦但不限于诱导住院、虚假住院、虚构病情、虚构诊疗、伪造文书、违规收费等违法违规使用...
2026-02-05 17:13
 资讯
资讯 国际SOS荣膺“2026年度全球杰出雇主”
今日,国际SOS宣布,公司连续第八年荣获杰出雇主调研机构(Top Employers Institute)授予的杰出雇主认证。
2026-02-05 14:42
 资讯
资讯 默克高管周虹离任,诺和诺德官宣在即,医药行业再迎关键人事变动
默克医药健康全球执行副总裁、中国及国际市场负责人周虹正式离任,其将加盟丹麦制药巨头诺和诺德,接任产品与组合战略执行副总裁一职
2026-02-05 11:58
 资讯
资讯 104亿元!2026年小核酸领域首笔出海BD诞生
圣因生物与罗氏集团旗下子公司基因泰克达成全球研发合作与许可协议,双方将基于圣因生物专有的RNAi药物研发平台,共同推进一款RNAi疗法的开发。
2026-02-05 11:50
 资讯
资讯 合成生物企业桦冠生物宣布完成数亿元C轮融资
本轮融资由软银欣创、顺禧基金、常州启航合成生物创投基金、国投创益、长江资本等多家知名机构联合投资,光源资本担任财务顾问,所融资金将重点投向医药与大健康领域新品研发、...
2026-02-04 11:50
 资讯
资讯 AI制药独角兽深度智耀完成6000万美元新一轮融资,加速全栈式研发解决方案落地
本轮融资吸引了信宸资本、金镒资本、凯泰资本等新投资方入局,老股东鼎晖百孚、新鼎资本持续追加投资
2026-02-03 20:03
 资讯
资讯 济川药业联合康方生物,共拓心血管创新药商业化新局
伊喜宁®(伊努西单抗注射液)是康方生物自主开发创新的PCSK9单克隆抗体新药,于2024年9月获批上市,用于治疗原发性高胆固醇血症和混合型高脂血症,包括杂合子家族性高胆固醇血...
2026-02-03 19:34
拜耳诺倍戈®第三项适应症在中国获批,用于治疗转移性激素敏感性前列腺癌(mHSPC)
诺倍戈®此前已先后获批用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者,和联合多西他赛治疗转移性激素敏感性前列腺癌的(mHSPC)成年患者。
2026-02-03 18:42
 资讯
资讯 又一款老花眼滴眼液获批,市场有待检验
近日,Tenpoint Therapeutics宣布,美国FDA已批准Yuvezzi(carbachol和brimonidine tartrate滴眼液,2 75% 0 1%),用于治疗成人老花眼。
2026-02-02 14:06
 资讯
资讯 深度缓解数据惊艳:基于诺奖机制的 CELMoD药物如何重塑 MM 治疗逻辑?
近期,国家药品监督管理局药品审评中心(CDE)将CELMoD药物 iberdomide (以下简称:IBER)纳入优先审评名单并启动优先审评程序,拟批准
2026-02-02 13:22
 资讯
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34