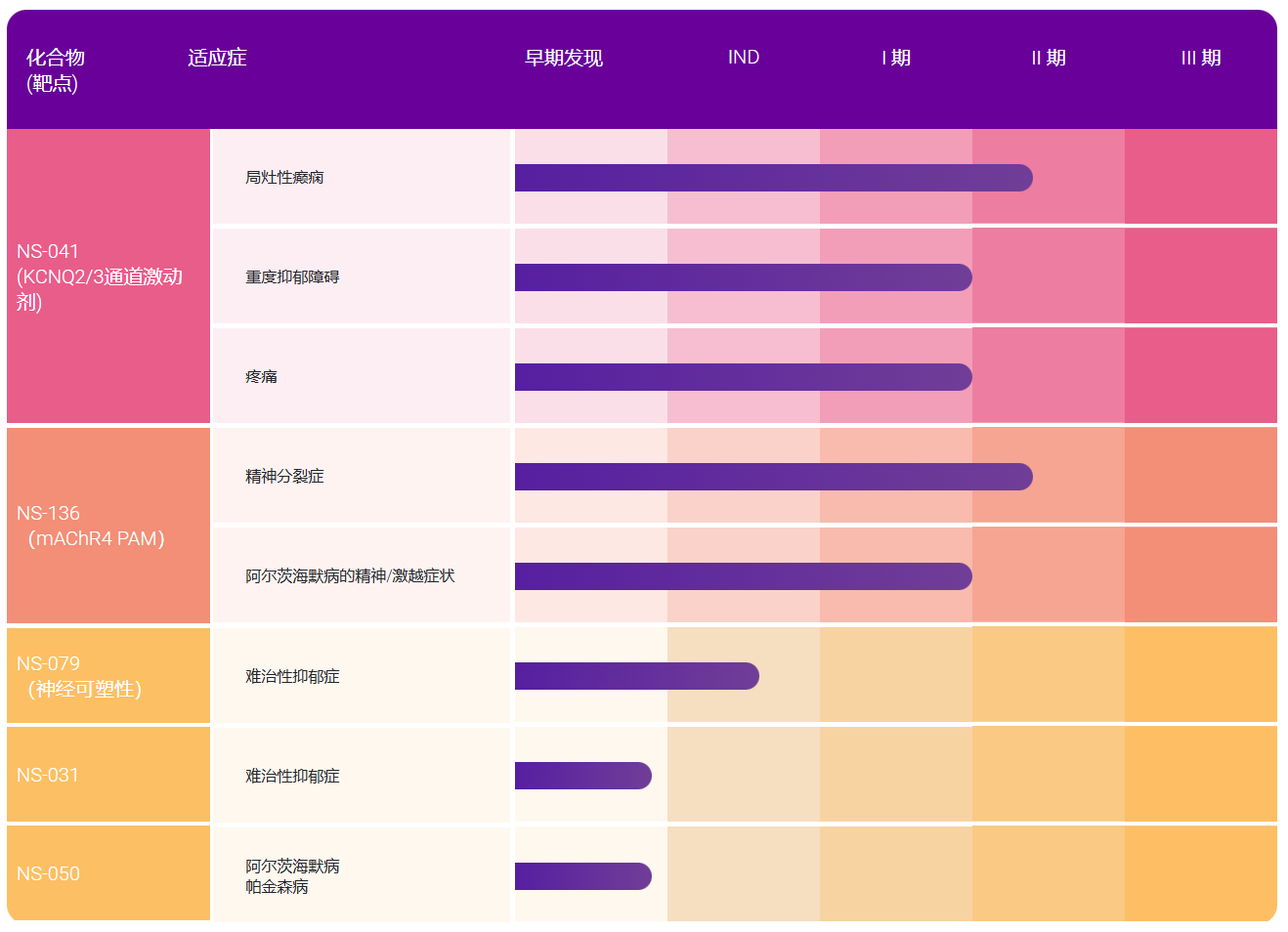
医谷4月23日消息,基石药业(苏州)有限公司(以下简称“基石药业”,香港联交所代码:2616)宣布,国家药品监督管理局(NMPA)已受理胃肠道间质瘤(GIST)精准靶向药物avapritinib的新药上市申请,涵盖两个适应症,分别为用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者,以及四线不可手术切除或转移性GIST成人患者。Avapritinib是一款强效、高选择性的、在研口服针对KIT和PDGFRA基因突变的抑制剂,由公司合作伙伴Blueprint Medicines开发。这也是基石药业首个获NMPA受理的新药上市申请,标志着其向商业化转型迈出重要一步。
中国每年约有1-1.5/10万(1.4万-2.1万)新诊断GIST患者,大概90%GIST患者的致病因素与KIT或PDGFRA基因突变有关。今年1月,FDA已批准其用于治疗携带PDGFRA外显子18突变的不可手术切除或转移性GIST成人患者,成为目前首个且唯一在美国上市的,针对PDGFRA外显子18突变治疗的精准靶向药。
基石药业董事长兼首席执行官江宁军博士表示:“在avapritinib获美国FDA批准上市仅三个月后,基石药业已分别在中国台湾和中国大陆地区递交avapritinib的新药上市申请,希望能尽快将这款同类首创的精准靶向药物带给大中华地区的晚期GIST患者。随着公司向商业化转型的步伐不断加速,未来几个月中,基石药业还将在中国递交多个重要产品针对多种适应症的新药上市申请。”
北京大学肿瘤医院副院长、消化肿瘤内科主任、avapritinib中国研究的主要研究者,沈琳教授表示:“Avapritinib在PDGFRA外显子18突变的晚期GIST,和在四线治疗的GIST患者中,均表现出了非常好的抗肿瘤活性,且安全性和耐受性良好。由于现有的疗法患者获益极为有限,所以这两类GIST患者具有高度未满足的治疗需求。作为临床医生,我期盼avapritinib能早日获批,成为晚期GIST患者新的治疗选择。”
2019年11月,CTOS年会上公布了NAVIGATOR I期临床试验中,关于avapritinib在PDGFRA外显子18突变和接受四线GIST患者中的研究结果。截止至2018年11月16日的数据显示:
入组的43例PDGFRA外显子18突变患者和111例四线治疗患者,均接受了每日一次avapritinib300mg或400mg的起始剂量,疗效可评估。
在PDGFRA外显子18突变患者中,ORR为86%(1例患者待确认),中位缓解持续时间(DOR)未达到
在四线治疗的GIST患者中,ORR达22%(1例患者待确认),中位DOR为10.2个月。
令人欣喜的是,目前基石药业开展的中国I/II期桥接研究的初步数据显示,中国GIST晚期患者的安全性及药代动力学特征数据均与NAVIGATOR全球研究数据一致,耐受性良好。
基石药业首席医学官杨建新博士表示:“目前,中国晚期GIST治疗方案主要为依次使用酪氨酸激酶抑制剂(TKIs),但已批准的TKI药物对携带PDGFRA外显子18 D842V突变的GIST患者疗效甚微。另一方面,中国四线GIST患者正面临着多种耐药突变、缺乏有效获批疗法等多重困境。我很高兴看到目前avapritinib在中国的桥接研究数据与NAVIGATOR全球研究结果一致,期待它能早日让更多亟待创新疗法的晚期GIST患者受益。"
基石药业成立于2015年底,专注于开发及商业化创新肿瘤免疫治疗及精准治疗药物,以满足中国和全球癌症患者的殷切医疗需求,已建立了一条15种肿瘤候选药物组成的丰富产品管线,其中5款后期候选药物正处于关键性临床试验。目前基石药业已与Blueprint Medicines达成独家合作和授权,获得了包括avapritinib在内的多款药物在大中华区的独家开发和商业化授权,Blueprint Medicines保留在世界其他地区开发及商业化相关药物的权利。
关于Avapritinib
Avapritinib是一款在研、强效、高选择性的KIT和PDGFRA突变激酶抑制剂。它是用于治疗GIST的1型激酶构象抑制剂,可直接与KIT和PDGFRA突变导致下游信号传导激活的活跃性激酶构象结合。Avapritinib已经证实了对GIST中KIT和PDGFRA广泛突变的抑制作用。目前,在大中华区已经获批的治疗方法的主要耐药机制是活化环突变导致。 而Avapritinib正是抑制这个部位突变,从而产生强效临床活性。
Blueprint Medicines 正在推进avapritinib更广泛的临床项目开发,包括针对跨越多线治疗的GIST , 和晚期,惰性和冒烟型系统性肥大细胞增多症(SM)。
Avapritinib是一款以AYVAKITTM 为产品名获美国FDA批准的激酶抑制剂,用于治疗携带PDGFRA 外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者。
Avapritinib尚未被美国FDA批准用于治疗任何其他适应症,且尚未被TFDA、NMPA或其它地区健康监管部门批准用于任何适应症。
为你推荐
 资讯
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
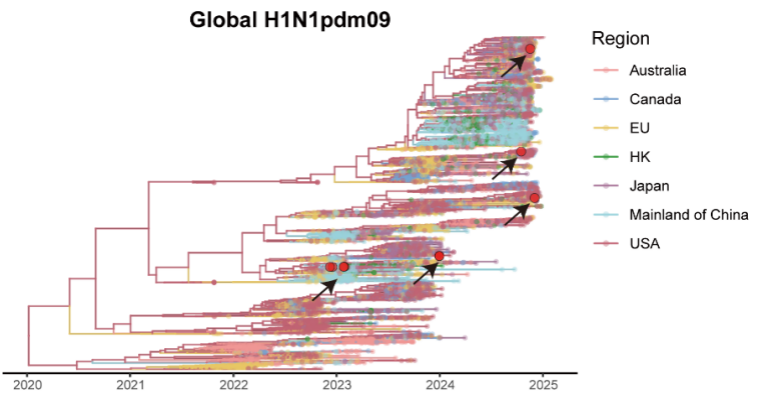 资讯
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22