对比中国和美国医药的投资回报率,中国在20%以上,美国只有3%,目前中国的风险没有美国高。
原因是美国创新药多,失败率高;而国内企业的临床试验,一方面是大多数还处于较早期的I期、II期临床阶段,进入III期较少,另一方面这些品类很多都是me-too或me-better,这类产品的临床成功率要高得多。
临床试验是一个成功率很低的活动
新药临床试验是一个成功率很低的活动,药物从I期临床试验开始要花很多的精力和资源,因此,临床试验失败的成本非常高。
根据数据统计,临床I、II、III期的成功率分别为63.2%、30.7%和58.1%,从下图可见,临床I、II、III期的成功率呈“V”型转折,II期的失败率远远高于I期和III期。
总体看,从I期到上市,临床研究的成功率不到10%,其中肿瘤药的成功率更低。
图1:各阶段临床试验成功率 & 不同适应症III期成功率
临床试验失败的主要原因
在不同临床研究阶段,临床试验失败的原因有所不同。
有文献对160个临床I期失败案例和89个临床II期失败案例的原因,从安全性、有效性以及公司策略等方面进行了分析。
发现临床I期失败最多的原因是安全性,因有效性失败的比例不足9%(14/157);到临床II期,失败最多的原因是有效性,比例达35%(31/89);而到了临床III期,有效性作为最主要的失败原因,占比高达55%。
图2:各阶段临床研究失败原因小结
而纵观整个临床研究,失败的主要原因有:
药物无效(无法控制)。
并不是每一个产品都会有预期的作用或者副作用。
临床试验设计问题(可以控制)。
如何根据资料、文献设计临床试验,减少临床试验失败风险成为主要课题。
操作问题(可以避免)。
临床试验人员的责任就是要把好药做成功。如果临床试验设计很合理,药物也很好,做失败了,那么这是做临床试验人员的失职,操作问题是我认为最应该避免的错误。
决策问题(决策很重要)。
公司在临床I期或者II期失败时候,如何评估失败产品?有没有足够的信息去评估(大多数情况下是没有完整的数据而必须做出决定)?如何决定是不是要继续投资?……
这些问题,其实是通过经验以及对资料的分析,对竞争格局的判断,还有公司内部策略等因素来进行决策的。因此,决策很重要。
Case study
怎样通过合理决策,避免III期临床失败?
案例1:辉瑞公司适应症为肾细胞癌的产品“舒尼替尼”(商品名:索坦)
舒尼替尼曾经做了很多临床试验,其中有七、八个III期临床试验失败。例如,乳腺癌的临床试验。II期临床的结果,舒尼替尼单臂临床实验应答率11%,而卡培他滨(商品名:希罗达)在同样的病人应答率为20%。但辉瑞决定继续开展这一临床试验的III期。
最终试验结果:舒尼替尼的无进展生存期(PFS)比对照组卡培他滨的短了一半,客观缓解率11%,而卡培他滨有16%。
回顾II期临床数据,这个III期失败完全可以被提前预测:拿一个本来就已经比对照组差的资料和数据,去决定继续进行III期临床研究,这有点像抱着侥幸心理——“万一成功了呢”?
通过这个案例可见,要尊重数据。这很重要。
案例2:辉瑞的一个IGF-1抑制剂:Figitumumab
II期临床试验结果显示:低剂量组10mg比对照组还差,高剂量组20mg比对照组稍好一点。
但如果调整7%、11%、46%和52%的crossover time,与对照组没有区别,即用药以后crossover变差,这是一个信号。
但是Sponsor认为还可以,因为高剂量组20mg hazard ratio从 0.8下降到0.56,结果变好。是不是还可以继续试验?
于是开展了两个大的III期临床试验,分别是:
“Figitumumab与厄洛替尼联用”
“Figitumumab与化疗药物联用”
这个临床试验还没做完就发现结果是阴性,被暂停,试验结果显示用药后试验组比对照组差,临床试验失败。这一项研究辉瑞在2009年发表了文章。
但是后来对临床试验数据进行数据梳理和确认发现:2009年数据有误,缓解率从78%下降到50%多,客观缓解率从54%变成37%,这说明当时没有充分确认,导致对结果错误报道,于是文章在2012年被撤回。
此外,即使当时特别看好的鳞癌中79%的应答率,也修正为后来的42%。改正前后的资料差异很大。由此做出做III期临床的决策,结果出来非常差。
案例3:IDO抑制剂
IDO临床一期和二期的结果显示55%的应答率。参照PD-1单一疗法约30%左右的应答率,他们认为从30到55增加了很多,这个结果看起来不错,但这是单臂、联用的临床试验。
然后,业界做了一大批III期临床试验,例如大公司BMS、Incyte就做了好几个临床。
今年6月份ASCO报道了该类临床试验结果:PFS的曲线用药组与对照组一模一样,OS也一模一样——试验的质量、结果都很好很可靠,但可惜IDO抑制剂是无效的。
案例4:Motesanib(AMG-706)
Motesanib是一种小分子多靶点酪氨酸激酶抑制剂(MTKI),是我当时领导开发的一个产品。
首先开展了一个180例甲状腺癌的II期单臂的临床试验。甲状腺癌有两种,甲状腺癌有两种,一种是MTC。(髓样甲状腺癌),一种是DTC(分化型甲状腺癌)。
试验结果对两种不同的甲状腺癌的组织学表现很好,肿瘤全部缩小。
这是一个较大的II期单臂临床试验,但与FDA沟通中,FDA认为这是单臂试验,因为没有对照组,无法判断药是不是有效,建议做一个随机的对照试验——但是这就要耽误很多年。
而后公司继续做其他II期试验,一个是乳腺癌,一个是非小细胞肺癌。乳腺癌试验有安慰剂和Avastin(bevacizumab)两个对照。
结果Motesanib和安慰剂早期有区别,晚期没有区别。试验结果比较差。在非小细胞肺癌中,是跟Avastin对比,试验结果跟Avastin差不多或者略差。
最后公司需要要做决定,下一步怎么做?甲状腺癌是否重新做,试验的成功率如何?并考虑到市场规模,竞争者等因素,我们认为:
虽然甲状腺癌试验结果很好,如果做临床试验基本上肯定成功,但是当时计算美国甲状腺癌市场规模只有5000万美元,5000万美元对于安进来说是太小的数字,根本不想做(不到5亿美元的市场规模大公司一般不大愿意去做这种产品)。
GBM(多形性胶质母细胞瘤)也可能成功,但也是很小的市场规模。
Sarcoma(肉瘤)也有很多资料证明这个产品可以成功,但是市场也很小。
乳腺癌、肺癌,都有很大的市场规模。但II期试验结果乳腺结果比较差,肯定不能做。肺癌结果虽然并不突出,但还是有点效果,跟Avastin差的可能不是很多。
于是,最后决定继续非小细胞肺癌试验。
于是,我们开展了一个III期临床试验,在30个国家150个sites,入组1500个病人。
结果如图,左边是无进展生存期PFS,右边是OS。PFS0.79的hazard ratio,OS是0.9,没有统计学显着差异,做了五年的临床试验宣告失败。
随后,对亚洲人亚组数据进行分析,结果发现亚洲病人结果特别好:非亚洲人是1.0的hazard ratio,没有差异;但是如果是亚洲人,PFS从对照组14.5个月到给药组20几个月,5个月的差异在非小细胞肺癌是一个巨大差异,而且0.669的Harzard ratio。
这个药在亚洲病人亚组的表现似乎很不错。并且我们做了各种各样的基线调整、治疗后区别,结果令人信服。
武田制药认为这很好,于是安进将产品授权武田,在日本继续做另一个三期临床试验。结果PFS 0.8,OS 0.9,跟之前全球研究一模一样的结果,试验失败了。
从这个临床试验得到的经验教训:
要尽早跟注册人员去沟通,确保你的策略能够注册。
Amgen最开始没有跟FDA讨论甲状腺癌的注册策略,因此导致单臂的II期临床试验虽然结果很好,但对于注册来说是无效的。
选择适应症一定不单单考虑市场,要看胜算多少,PTRS很重要。
例如甲状腺癌虽然适应症很小,市场规模不大,但有一个适应症能上市,有销售收入然后再做其他的话,比一个适应症都没批就失败要好得多。
对临床试验亚组的分析要非常非常的谨慎。
因为亚组是一种“假设成立”,是去衍生发展一个潜在的假设,因此基于产品的亚组分析一定要去确认是不是真的,确认的方法就是依据随机、对照临床试验。我认为这是很重要的一个教训。
Case study
产品的开发策略也很关键
案例5:Regorafenib
上述案例4的产品Motesanbi其实跟这些索坦很相似,都是anti-VEGF。
当时所有的anti-VEGF的小分子药全做结直肠癌,一线治疗全失败,包括Sutent、Nexavar、Recentin、Motesanib,他们做fisrt line跟化疗联用的一线治疗,临床试验III期全都失败。
但有一个成功的产品是拜耳的瑞格非尼(Regorafenib)。为什么成功?这个产品做的一个三线的单药临床试验。
当时独树一帜,因为没有人考虑做一个单药三线临床试验。用的对照相当于就是安慰剂,没什么治疗作用。结果0.77的Hazard ratio,不算特别好,OS是从5个月延长到6.4个月。
由此可见,产品开发策略也很关键。
案例6:Rilotumumab
这是Amgen的另一个产品Rilotumumab,虽然我不是主要负责,但是也介入一些开发工作。
II期临床试验结果一般。右边Over Survival曲线,有点区别,但不是很大,0.7几的Hazard Ratio,这时Amgen公司已经宣布把这个项目终结。
结果做完试验,课题组做了一个样本分析,又是subset分析。如果看cMET高的病人,结果差别大,OS 0.48 Hazard ratio,看Median的差不多是2倍,很好的结果。
根据subset分析,Amgen开展一个全球多中心的,600例病人的胃癌一线III期临床试验。
试验尚未做完,中期分析就显示试验失败了,不但失败,对照组比给药组明显更好,1.36的Hazard ratio,增加36%的死亡风险。
最后结论,用Rilotumumab对胃癌的OS没有影响且有风险。
Amgen宣布结束Rilotumumab的临床试验。之前已经终结过的项目,花这么多钱以后又重新终止,即通过一个小样本的亚组分析来主导一个III期临床试验设计非常危险。
所以subst分析可能会误导、可能会非常危险!
案例7:Ramucirumab
但是,基于Subst分析的III期临床试验有没有成功的呢?也有。像礼来的产品Ramucirumab。
Ramucirumab是一个anti-VEGF2的抗体,做了一个肝癌的II期临床试验,结果0.86 的Hazard ratio,有一点点区别但不是很多。
Subset分析发现如果病人baseline的AFP大于等于400ng/mL,结果看起来不错,0.67 Hazard ratio。
礼来基于此开展了二线肝癌的III期临床试验。III期临床试验结果跟II期差不多,0.67 Hazard ratio,临床试验成功,获得美国FDA肝癌二线治疗的批准。
这个Subset比较大,而且它是预先设定的,这是Subst分析很重要的两点。
如何减少III期临床失败的风险?
减少III期临床风险这个任务有时候是可能的,有时候是不可能的。
因为很多时候小样本的II期临床试验并不能让我们了解一个分子的全部特性,所以失败是肯定的。
但我们的责任是要减少,最小化那些不应该失败的错误。
详细深入地了解研究资料,靶点,早期数据,安全性等,非常重要。
要合理开展I期、II期早期临床试验。
众多的IDO III期临床试验,没有一个II期是随机的,全是新单臂联合试验。
联合试验如果是II期单臂,很危险,因为产生结果的原因并不清楚,联合用药时,是不是里面每一个药都有用——这在结果从10%增加到90%时容易判断,但如果如果结果是从40%增加到60%,则不容易判断。
客观仔细分析所有可获得的数据很重要。
看自己做的项目就像看自己的宝宝,可能不完美,只看好的不看坏的。因此,不要忽略不好的数据,不能只看高剂量结果很好,而不去问低剂量组为什么不好?
科学永远是对的,但我们不会知道全部。例如,为什么一个产品在高剂量有效,在低剂量不但无效而且更差,这是个很大的警示信号,一定要注意这样的数据。
还要有robust hypothesis,不能想当然或者存在侥幸心理。
Smart设计也很重要。
病人的选择,选什么样的临床试验设计,我觉得simple design is the best,越复杂越麻烦,例如A与 B对比,或者是“A与其他合用”与A对比,都是比较好的简单设计。
注意安全性,这也是临床试验失败的很重要原因。
注意地域性差别。
中国国内可能有这种差别,中国东北和南方区别可能也有一些,但不是很大。美国或者全球的区别会很大。有时候会因为一个区域造成临床试验失败的例子也很多。
高效、高质量开展也是减少III期临床失败很重要的因素。
运气也是成功因素之一,只是我们不能控制而已。
新药研发失败率很高,有时候真的需要一点好运气,像K药差点被毙掉。
来源:同写意 作者:写意君
为你推荐
 资讯
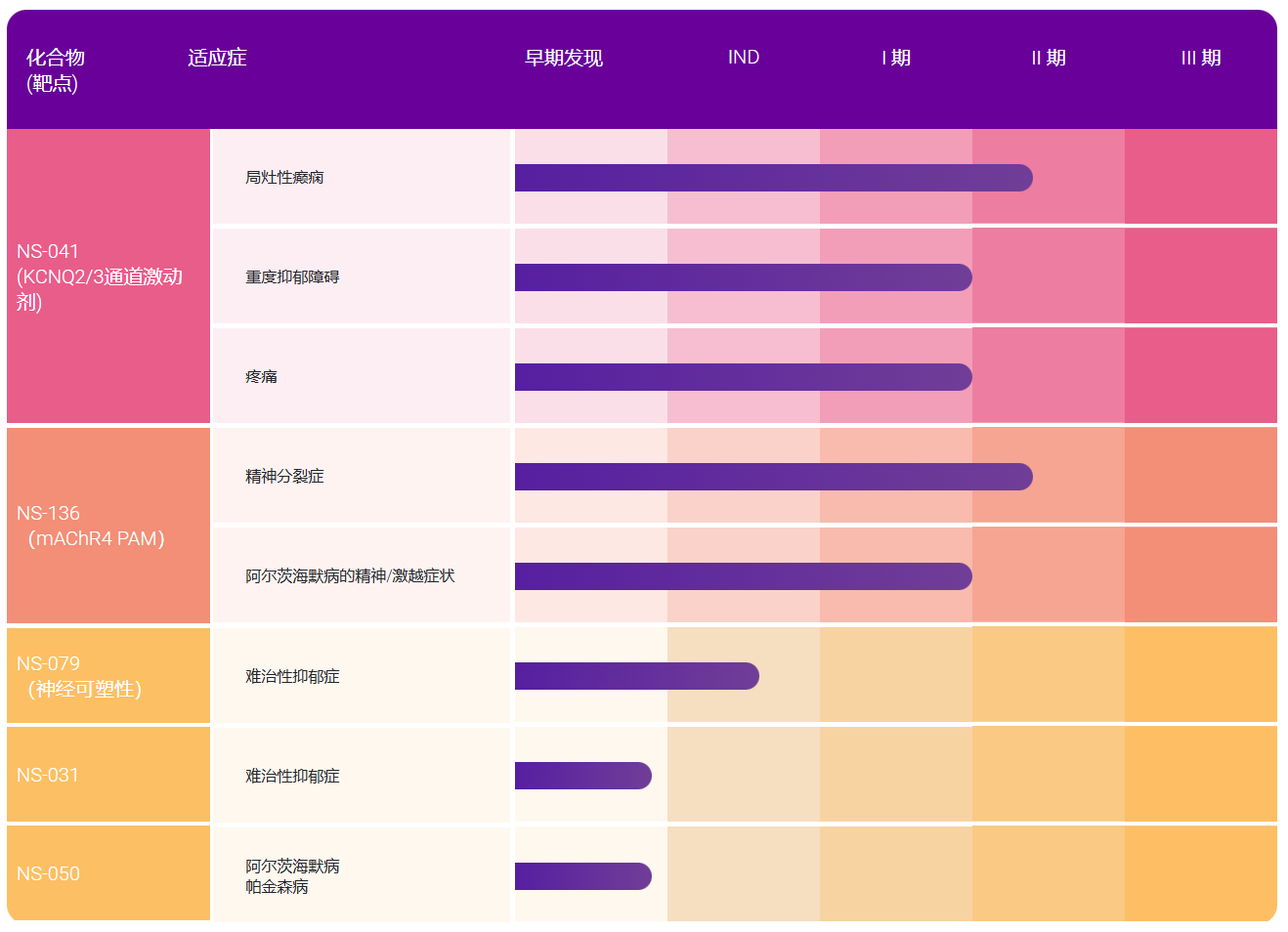
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
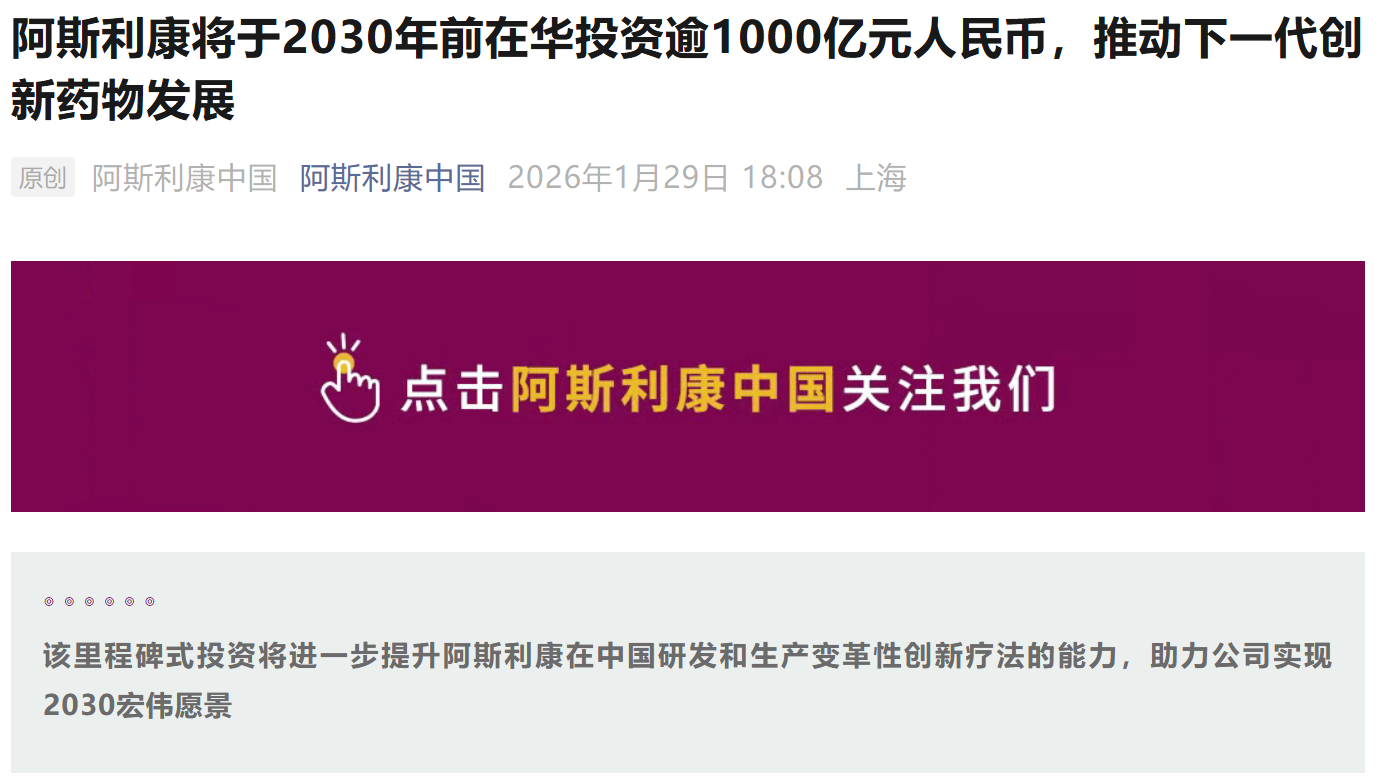
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
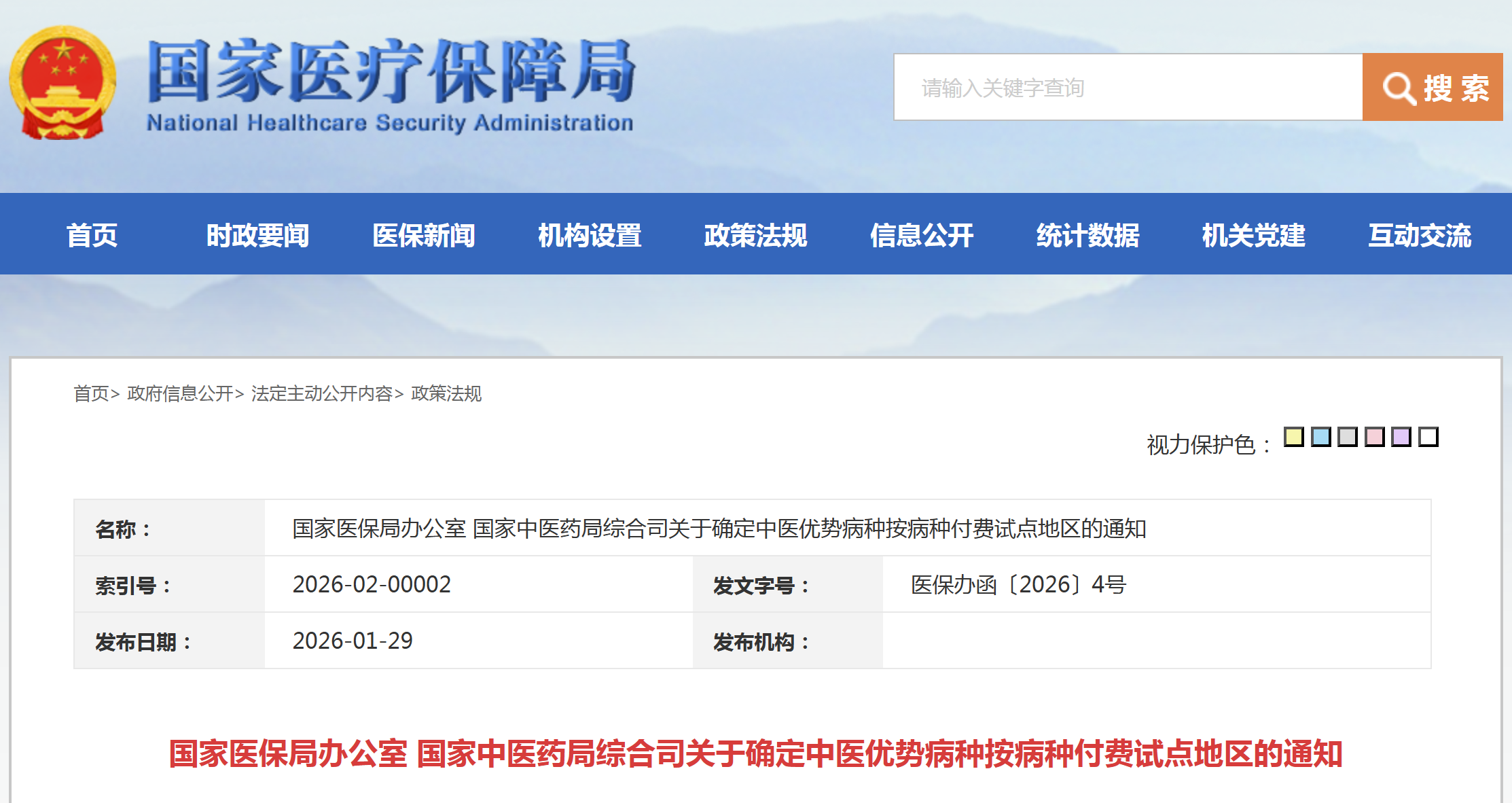
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
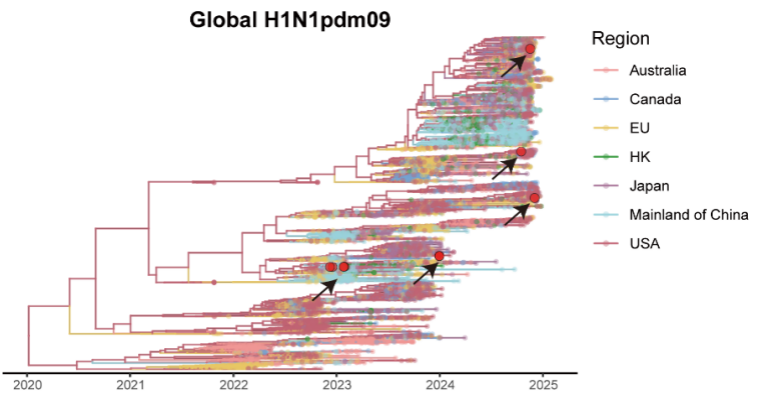
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22