今日,国家市场监管总局就《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)》向社会公开征求意见,意见建议反馈截止时间为2019年4月12日。
根据意见稿,国家市场监管总局统一规定了“三品一械”广告审查的标准和程序。《办法》共6章,35条,包括广告审查标准、广告审查程序、广告发布要求等。
其中,值得注意的是,关于“三品一械”广告内容要求,《办法》中规定,“三品一械”广告内容表述“仅限于产品注册证明文件或者备案凭证、产品说明书中的内容”。产品注册证明文件或者备案凭证、产品说明书是经过市场监管部门或者药品监管部门的严格审批,其内容能够准确反映“三品一械”产品属性,并能够真实、客观的向消费者提供相关产品信息,避免在广告中夸大其词,劝诱消费者过量购买和使用相关产品。这样规定还有利于避免由于广告审查人员对审查标准认识理解的不同,导致同一或者类似内容广告审查结果不一致的问题,有效维护“三品一械”广告市场秩序。
《广告法》中对“三品一械”广告应当显著标明的内容做出了具体规定。《办法》中规定,“三品一械”广告除应当显著标明《广告法》中规定的内容外,还应标注与消费者知情权和选择权密切相关的其他内容,包括广告批准文号、非处方药标识,保健食品标识、适宜人群和不适宜人群,特殊医学用途配方食品的适用人群等。
同时,《办法》规定广告申请人必须为药品、医疗器械上市许可持有人,保健食品、特殊医学用途配方食品注册人或者备案人,广告申请人对广告的真实性、合法性负责。
此外,《办法》中增加了延续广告批准文号有效期的相关程序。规定广告申请人应当自广告批准文号有效期届满30日前,向原编发广告批准文号的广告审查机关提交广告批准文号有效期延续申请书,对符合要求的,广告审查机关应当当场予以延续。
附政策全文
市场监管总局关于《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)》公开征求意见的公告
为加强药品、医疗器械、保健食品和特殊医学用途配方食品广告审查发布管理工作,根据《中华人民共和国广告法》等法律法规的规定,市场监管总局组织起草了《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)》,现向社会公开征求意见。公众可以通过以下途径和方式提出意见建议:
一、通过电子邮件将意见建议发送至:ggsglc@saic.gov.cn,邮件主题请注明“《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)》公开征集意见”字样。
二、将意见建议邮寄至:北京市西城区三里河东路8号(邮编100820)国家市场监督管理总局广告监管司,并在信封上注明“《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)》公开征集意见”字样。
三、将意见建议传真至010-68050321。
意见建议反馈截止时间为2019年4月12日。
附件:
1.药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)
第一章 总则
第一条 为加强药品、医疗器械、保健食品和特殊医学用途配方食品广告审查发布管理工作,根据《中华人民共和国广告法》《中华人民共和国食品安全法》《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》和《医疗器械监督管理条例》等法律法规,制定本办法。
第二条 药品、医疗器械、保健食品和特殊医学用途配方食品广告的审查、发布适用本办法。
未经审查不得发布药品、医疗器械、保健食品和特殊医学用途配方食品广告。
第三条 药品、医疗器械、保健食品和特殊医学用途配方食品广告应当符合《中华人民共和国广告法》等相关法律法规的规定,内容科学、准确,引导消费者合理使用,不得直接或者间接劝诱消费者任意、过量购买和使用产品。
第四条 特殊医学用途配方食品中的特定全营养配方食品(以下简称特定全营养配方食品)广告按照处方药广告管理,其他类别特殊医学用途配方食品广告按照非处方药广告管理。
第五条 国家市场监督管理总局负责组织指导药品、医疗器械、保健食品和特殊医学用途配方食品广告审查工作。
各省级广告审查机关(以下简称广告审查机关)负责药品、医疗器械、保健食品和特殊医学用途配方食品广告审查。
第二章 广告审查标准
第六条 药品、医疗器械、保健食品和特殊医学用途配方食品广告内容表述仅限于产品注册证明文件或者备案凭证、产品说明书中的内容。
第七条 药品、医疗器械、保健食品和特殊医学用途配方食品广告中应当显著标明广告批准文号和下列内容:
(一)药品广告应当显著标明禁忌、不良反应。处方药广告还应当显著标明“本广告仅供医学药学专业人士阅读”,非处方药广告还应当显著标明非处方药标识(OTC)和“请按药品说明书或者在药师指导下购买和使用”;
(二)推荐给个人自用的医疗器械广告,应当显著标明“请仔细阅读产品说明书或者在医务人员的指导下购买和使用”。医疗器械注册证明文件或者备案凭证中有禁忌内容、注意事项的,应当显著标明“禁忌内容或者注意事项详见说明书”;
(三)保健食品广告应当显著标明保健食品标识、适宜人群、不适宜人群和“本品不能代替药物”;
(四)特殊医学用途配方食品广告应当显著标明适用人群、“不适用于非目标人群使用”“请在医生或者临床营养师指导下使用”。
按照前款规定应当显著标明的内容,其字体和颜色必须清晰可见、易于辨认,在视频广告中应当始终出现。
第八条 药品、医疗器械、保健食品和特殊医学用途配方食品广告不得出现下列情形:
(一)利用广告代言人作推荐、证明;
(二)使用医药科研单位、学术机构、行业组织、医疗机构或者专家、医生、患者的名义和形象;
(三)使用军队单位或者军队人员的名义和形象;
(四)制作成新闻报道形式或者介绍健康、养生知识、医疗服务资讯等节目(栏目)形式;
(五)法律、行政法规规定的其他不得出现的情形。
第三章 广告审查程序
第九条 药品、医疗器械、保健食品和特殊医学用途配方食品广告申请人(以下简称广告申请人)必须是药品、医疗器械的上市许可持有人和保健食品、特殊医学用途配方食品的注册人或者备案人。广告申请人对广告内容的真实性负责。
广告申请人可以委托代理人办理药品、医疗器械、保健食品和特殊医学用途配方食品广告审查申请。
第十条 药品、医疗器械、保健食品、特殊医学用途配方食品广告审查申请应当向广告申请人所在地的广告审查机关提出。
中国境外广告申请人应当向其在中国境内设置的代表机构或者委托中国境内代理机构所在地的广告审查机关提出药品、医疗器械、保健食品、特殊医学用途配方食品广告审查申请。
第十一条 申请药品、医疗器械、保健食品、特殊医学用途配方食品广告审查,应当提交《广告审查表》、申请审查的广告样稿,以及下列真实、合法、有效的证明材料。
(一)广告申请人的主体资格证明材料;
(二)产品注册证明文件或者备案凭证、产品说明书;
(三)委托代理人进行申请的,还应当提交代理人的主体资格证明材料,广告申请人加盖公章的授权委托书。
第十二条 广告审查机关收到药品、医疗器械、保健食品、特殊医学用途配方食品广告审查申请后,对申请材料符合要求的,予以受理;申请材料不符合要求的,应当当场或者在5个工作日内一次性告知申请人或者代理人需要补正的全部内容;逾期不告知的,自收到申请材料之日起即为受理。
第十三条 广告审查机关应当自受理之日起10个工作日内,对广告申请人提交的证明材料和广告样稿进行审查。对符合法律、行政法规和本办法规定的,广告审查机关应当予以通过,编发广告批准文号,并在7个工作日内向社会公开。审查未通过的,应当通知广告申请人或者代理人并说明理由,同时告知其享有依法申请行政复议或者提起行政诉讼的权利。
第十四条 药品、医疗器械、保健食品和特殊医学用途配方食品广告批准文号有效期为1年。
第十五条 药品、医疗器械、保健食品和特殊医学用途配方食品广告内容发生变化的,应当重新申请广告批准文号。
第十六条 药品、医疗器械、保健食品和特殊医学用途配方食品广告内容未发生变化的,广告申请人可以申请延续广告批准文号有效期。
第十七条 申请延续广告批准文号有效期的,应当自广告批准文号有效期届满30日前向原编发广告批准文号的广告审查机关提出,并提交广告批准文号有效期延续申请书,在申请书中应当承诺药品、医疗器械、保健食品和特殊医学用途配方食品广告未发生任何变化。
第十八条 广告审查机关收到广告批准文号有效期延续申请后,可以不再审查该广告,但应当审查广告申请人主体资格和产品注册证明文件或者备案凭证是否发生变化。对符合要求的,应当当场办理延续。
第十九条 有下列情形之一的,广告审查机关应当注销药品、医疗器械、保健食品和特殊医学用途配方食品广告批准文号:
(一)广告批准文号有效期届满且未延续的;
(二)广告申请人的主体资格有效期届满且不再延续,或者被吊销、撤销、注销的;
(三)产品注册证明文件或者备案凭证有效期届满且不再延续,或者被撤销、注销的;
(四)广告申请人申请注销的;
(五)法律法规规定应当注销的其他情形。
广告申请人符合前款第(二)项、第(三)项情形的,应当主动向广告审查机关申请注销广告批准文号。
第二十条 对已经审查通过的药品、医疗器械、保健食品和特殊医学用途配方食品广告,国家市场监督管理总局认为有必要的,可以直接组织复审或者要求相关广告审查机关进行复审。广告审查机关可以直接对本部门审查通过的药品、医疗器械、保健食品和特殊医学用途配方食品广告进行复审。
省级市场监督管理部门发现其他地区审查通过的药品、医疗器械、保健食品和特殊医学用途配方食品广告需要复审的,应当向国家市场监督管理总局提出复审建议。
复审前,应当向广告申请人或者代理人发出复审通知书。复审期间,可以暂停该药品、医疗器械、保健食品和特殊医学用途配方食品广告的发布。
复审工作应当自发出复审通知书10个工作日内完成。经复审,药品、医疗器械、保健食品和特殊医学用途配方食品广告不符合有关法律、法规、规章规定的,由原广告审查机关撤销该广告批准文号,将复审结果通知广告申请人或者代理人,并向社会公开。
第四章 广告发布要求
第二十一条 发布药品、医疗器械、保健食品和特殊医学用途配方食品广告应当符合《中华人民共和国广告法》等法律法规要求,严格按照审查通过的内容发布,不得对审查通过的内容进行剪辑、拼接、修改等处理。
第二十二条 被注销、撤销广告批准文号的药品、医疗器械、保健食品和特殊医学用途配方食品广告,应当立即停止发布。
第二十三条 下列药品、医疗器械、保健食品和特殊医学用途配方食品不得发布广告:
(一)麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品,以及戒毒治疗的药品、医疗器械;
(二)军队特需药品;
(三)医疗机构制剂;
(四)适用于0月龄至12月龄的特殊医学用途配方食品。
(五)依法停止或者禁止生产、销售或者使用的药品、医疗器械、保健食品和特殊医学用途配方食品。
第二十四条 处方药和特定全营养配方食品广告只能在国务院卫生行政部门和国务院药品监督管理部门共同指定的医学、药学专业刊物上发布。
第二十五条 涉及改善和增强性功能内容的药品、医疗器械广告,不得在报纸头版、期刊封面、网站首页,以及电视、广播7:00—22:00发布。
第二十六条 在药品广告申请人(境外广告申请人在中国境内设置的代表机构或者其委托的中国境内代理机构)所在地以外的省、自治区、直辖市发布药品广告的,发布前应当向发布地药品广告审查机关提交承诺书进行备案,并向广告发布者承诺备案情况。
广告申请人对本条第一款规定承诺的事项负法律责任。
第五章 法律责任
第二十七条 有下列情形之一的,按照《中华人民共和国广告法》第五十八条处罚,情节严重的,可以由省级市场监督管理部门暂停该产品在本行政区域内销售。
(一)违反本办法第二条第二款规定,未经审查发布药品、医疗器械、保健食品和特殊医学用途配方食品广告;
(二)违反本办法第二十一条规定,未按照审查通过的内容发布药品、医疗器械、保健食品和特殊医学用途配方食品广告;
(三)违反本办法第二十二条规定,广告批准文号被注销、撤销后仍然发布药品、医疗器械、保健食品和特殊医学用途配方食品广告。
第二十八条 违反本办法第二十三条、第二十四条规定的,按照《中华人民共和国广告法》第五十七条处罚。
第二十九条 违反本办法第二十五条规定的,责令改正,对广告发布者处一万元以上三万元以下罚款。
第三十条 违反本办法第二十六条第一款规定的,由广告发布地市场监督管理部门责令限期改正;逾期不改的,停止该药品在发布地的广告发布。
第三十一条 有下列情形之一的,按照《中华人民共和国广告法》第六十五条处罚。
(一)隐瞒真实情况或者提供虚假材料申请药品、医疗器械、保健食品和特殊医学用途配方食品广告审查的;
(二)以欺骗、贿赂等不正当手段取得药品、医疗器械、保健食品和特殊医学用途配方食品广告批准文号的。
第三十二条 广告审查机关的工作人员玩忽职守、滥用职权、徇私舞弊的,依法给予处分。构成犯罪的,依法追究刑事责任。
第六章 附则
第三十三条 符合下列情形之一的,无需审查。
(一)仅宣传非处方药品、医疗器械、保健食品和除特定全营养配方食品外其他类别特殊医学用途配方食品名称的;
(二)处方药和特定全营养配方食品在国务院卫生行政部门和国务院药品监督管理部门共同指定的医学、药学专业刊物上只宣传产品名称的。
第三十四条 药品、医疗器械、保健食品和特殊医学用途配方食品广告申请人、广告经营者、广告发布者应当将《广告审查表》和审查通过的广告样稿保存2年备查。
第三十五条 本办法自xxxx年x月x日起施行。原食品、保健食品、药品、医疗器械、特殊医学用途配方食品广告审查有关部门规章和规范性文件同时废止。
2.药品、医疗器械、保健食品、特殊医学用途配方食品广告审查发布管理办法(征求意见稿)起草说明
来源:医谷网综合报道
为你推荐
 资讯
资讯 康龙化成与礼来达成口服GLP-1小分子药Orforglipron生产合作协议
3月11日晚间,康龙化成官方微信发布消息,康龙化成与礼来公司共同宣布,达成关于首个申报注册的口服小分子GLP-1受体激动剂Orforglipron的生产合作协议。
2026-03-12 21:56
 资讯
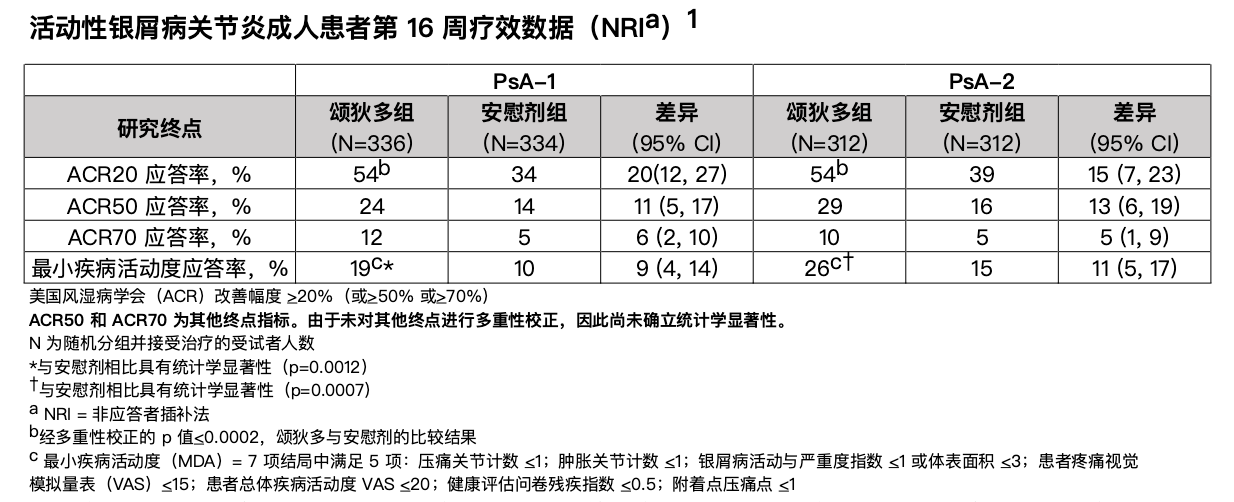
资讯 美国 FDA 批准颂狄多(氘可来昔替尼)用于治疗活动性银屑病关节炎成人患者
颂狄多是一种口服选择性酪氨酸激酶 2(TYK2)抑制剂,也是首个获批用于 PsA治疗 的 TYK2 抑制剂
2026-03-12 16:53
 资讯
资讯 百时美施贵宝宣布口服药物mezigdomide治疗复发或难治性多发性骨髓瘤Ⅲ期研究SUCCESSOR-2的积极结果
这是mezigdomide首项获得积极结果的Ⅲ期研究,也是百时美施贵宝CELMoD项目第二项获得积极成果的Ⅲ期研究
2026-03-11 21:15
 资讯
资讯 备思复联合帕博利珠单抗使顺铂耐受的肌层浸润性膀胱癌患者的复发或死亡风险降低近 50%
在 III 期临床研究 EV-304 中,该联合疗法显著改善患者总生存期与病理完全缓解率,超半数患者在手术时未检测到病灶
2026-03-11 13:17
 资讯
资讯 降 HbA1c 超 2.5%且多重获益,华东医药国产降糖新药HDM1005降糖2期数据揭晓
本次研究为一项在饮食和运动或二甲双胍治疗后血糖控制不佳的2型糖尿病受试者中评价HDM1005注射液有效性和安全性的多中心、随机、盲法、平行、安慰剂和阳性对照的Ⅱ期临床研究
2026-03-10 19:38
 资讯
资讯 艾凯生物完成A3轮超亿元融资,加速AI驱动iPSC细胞治疗与类器官平台升级
本轮融资由知壹投资与沃杰资本联合领投,联新资本持续追加投资,资金将重点用于推进AI驱动的iPSC细胞治疗产品临床转化,加速完善iPSC细胞治疗与类器官两大核心技术平台布局。
2026-03-10 18:22
 资讯
资讯 中科搏锐斩获数千万B轮融资,推动脑机接口全产业链产业化落地
本轮融资由国内知名投资机构三泽创投独家投资,凯乘资本担任长期独家财务顾问,所筹资金将全力支撑公司深化脑机接口全产业链布局,加速尖端技术的临床转化与产业化落地。
2026-03-10 18:03
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41