在“魏则西”事件热度开始渐渐消退后,继5月4日,卫计委医政管理司召集全国各省市卫生局医管部门进行电视电话会议,要求各省市医院停止自体免疫细胞治疗技术的临床应用,而仅限于临床研究,并且要求禁止医院变相承包科室后,5月16日,广东省卫生计生委和广东省中医药局联合印发了《关于进一步规范医疗机构科室管理和医疗技术管理的通知》(以下简称通知)。
通知明确政府举办的非营利性医疗机构不得投资与其他组织合资合作设立非独立性法人资格的营利性的“科室”、“病区”、“项目”。各级各类医疗机构要对本机构涉及“对内实行经济独立核算、对外合作的科室、项目,或其他个人或者组织合作购置医疗设备的情况”进行自查和清理。对已经出租的、变相出租承包的或者违规合作项目,必须立即取消或终止。
此外 ,通知重申,禁止临床应用的医疗技术,医疗机构禁止开展,限制临床应用的医疗技术,实施备案管理。 若医疗机构未按本通知要求进行备案或开展禁止临床应用医疗技术的,由卫生计生行政部门按照《医疗机构管理条例》第四十七条和《医疗技术临床应用管理办法》第五十条的规定给予处罚。医疗机构开展的需要限定条件的医疗技术目录应当纳入本机构院务公开范畴,主动向社会公开,接受社会监督。
对于干细胞(造血干细胞、脐带血造血干细胞除外)治疗技术、自体免疫细胞治疗技术等作为未列入限制临床应用的医疗技术,按照临床研究管理,不得直接应用于临床。医疗机构开展干细胞、自体免疫细胞等治疗技术的临床研究工作,必须严格执行《干细胞临床研究管理办法(试行)》等有关规定,遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则,且不得向受试者收取临床研究相关费用。
附广东省卫生计生委 广东省中医药局关于进一步规范医疗机构科室管理和医疗技术管理的通知
粤卫函〔2016〕551号
各地级以上市及顺德区卫生计生局(委),部属、省属驻穗医药院校附属医院及委直属医院:
按照国家卫生计生委医政医管局规范医疗机构科室管理及医疗技术临床应用管理视频会议精神,为进一步强化医疗机构依法执业意识,保障医疗质量和医疗安全,现就进一步规范医疗机构科室管理和医疗技术临床应用管理工作通知如下:
一、规范医疗机构科室运行与管理
根据《医疗机构管理条例》第二十三条和原卫生部、国家中医药管理局、财政部和国家计委联合印发的《关于城镇医疗机构分类管理的实施意见》(卫医发〔2000〕233号)的相关要求,“政府举办的非营利性医疗机构不得投资与其他组织合资合作设立非独立性法人资格的营利性的‘科室’、‘病区’、‘项目’”。各级各类医疗机构要对本机构涉及“对内实行经济独立核算、对外合作的科室、项目,或其他个人或者组织合作购置医疗设备的情况”进行自查和清理。对已经出租的、变相出租承包的或者违规合作项目,必须立即取消或终止。各级卫生计生行政部门要切实加强对辖区内医疗机构的监督管理,督促指导辖区内所有医疗机构进行自查,并定期组织检查。对存在上述违规行为的,一经查实,按照《医疗机构管理条例》等相关规定严肃处理。同时,落实责任追究制度,对存在问题拒不整改或整改情况不到位的医疗机构,要坚决依法依规追究相关负责人的责任。
二、加强医疗技术临床应用管理
根据《国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知》(国卫医发〔2015〕71号,以下简称71号文)和《广东省人民政府关于取消非行政许可审批事项的决定》(粤府〔2015〕86号),医疗技术临床应用取消准入审批,实施事中事后监管。医疗技术根据安全性、有效性等实施分类管理。
(一)禁止临床应用的医疗技术(附件1),医疗机构禁止开展。
(二)限制临床应用的医疗技术(附件2),实施备案管理。医疗机构开展此类技术临床应用的,应当按要求进行评估、论证,经临床技术应用伦理委员会审核同意后方可临床应用。同时,医疗机构应向核发其《医疗机构执业许可证》的卫生计生行政部门申请在副本备注栏注明,并在新技术开展后10日内向省级卫生计生行政部门备案(备案说明见附件3)。已经审核开展的医疗技术,请于2016年5月20日前完成备案。
(三)根据71号文,干细胞(造血干细胞、脐带血造血干细胞除外)治疗技术、自体免疫细胞治疗技术等作为未列入限制临床应用的医疗技术,按照临床研究管理,不得直接应用于临床。医疗机构开展干细胞、自体免疫细胞等治疗技术的临床研究工作,必须严格执行《干细胞临床研究管理办法(试行)》等有关规定,遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则,且不得向受试者收取临床研究相关费用。
医疗机构对已证明安全有效,但属本机构首次应用的医疗技术,应当组织论证,重点论证本机构技术能力和安全保障能力,通过论证的方可开展;对已经临床应用的医疗技术,应当定期进行评估,重点评估技术的适宜性、有效性和质量安全情况。对于质量、安全存在重大问题以及落后、淘汰的医疗技术,应当及时停止临床应用,并调整出本机构医疗技术临床应用管理目录。各级卫生计生行政部门应加强对辖区内医疗机构开展临床研究工作的指导和监督,禁止医疗机构开展禁止类、临床研究类医疗技术的临床应用;对违规开展该技术临床应用的,依法依规严肃查处。
三、明确各级职责,强化依法执业意识
取消医疗技术临床应用审批后,医疗机构对本机构医疗技术临床应用和管理承担主体责任。医疗机构法定代表人是本机构医疗机构临床应用管理的第一责任人。各级各类医疗机构应当强化主体责任意识,建立完善医疗技术临床应用管理制度,制定本机构医疗技术临床应用管理目录并及时调整,对目录内的手术进行分级管理。建立医师手术授权与动态管理制度,建立健全医疗技术评估与管理档案制度,建立医疗技术临床应用质量控制和管理制度。
医疗机构未按本通知要求进行备案或开展禁止临床应用医疗技术的,由卫生计生行政部门按照《医疗机构管理条例》第四十七条和《医疗技术临床应用管理办法》第五十条的规定给予处罚。医疗机构开展的需要限定条件的医疗技术目录应当纳入本机构院务公开范畴,主动向社会公开,接受社会监督。
各级卫生计生行政部门应当依据职责加强对辖区内医疗机构医疗技术临床应用情况的监管管理。可通过日常巡查、随机抽查、专项督查、专项整治、事后评估评价等方式,完善常态化监管机制,提高监管水平,督促医疗机构落实主体责任,强化内部管理。卫生计生行政部门可依托各专业医疗质量控制中心,对需要加强管理的医疗技术临床应用情况进行质量控制,对医疗技术临床应用情况进行日常监测与定期评估,及时向医疗机构反馈质控和评估结果,并可作为监管的依据。
四、开展专项检查全面清理整顿
本通知下发之日起,各地各单位要立即组织开展医疗机构科室管理和医疗技术临床应用情况专项检查,对违规行为进行全面清理。各地级以上市卫生计生局组织对辖区内医疗机构科室管理和医疗技术临床应用情况进行专项检查,并将有关情况于2016年5月23日前报省卫生计生委医政处;部属、省属驻穗医药院校附属医院及委直属医院迳报省卫生计生委医政处,中医院相关材料同时报省中医药局医政处(请同时报送加盖公章纸质版、word版和加盖公章纸质版扫描件)。
省卫生计生委医政处联系人:姚瑞洁,联系电话:020-83872408,电子邮箱:wstyizhengchu@126.com;
省中医药局医政处联系人:孙玲玲,联系电话:020-83063506,电子邮箱:gdzyyz@126.com。
附件1禁止临床应用的医疗技术
临床应用安全性、有效性存在重大问题的医疗技术(如脑下垂体酒精毁损术治疗顽固性疼痛)。或者存在重大伦理问题(如克隆治疗技术、代孕技术),或者卫生计生行政部门命令禁止临床应用的医疗技术(如除医疗目的以外的肢体延长术),以及临床淘汰的医疗技术(如角膜放射性切开术)。医疗机构禁止使用。
涉及使用药品、医疗器械或具有相似属性的相关产品、制剂等的医疗技术,在药品、医疗器械或具有相似属性的相关产品、制剂等未经食品药品监督管理部门批准上市前,医疗机构不得开展临床应用。
未经临床研究论证,安全性、有效性不确切的医疗技术,医疗机构不得开展临床应用。
原第三类医疗技术目录中未列入“限制临床应用”清单的医疗技术(主要指自体免疫细胞治疗技术)属于临床研究范畴,禁止开展临床应用,按照临床研究的相关规定执行。
附件2限制临床应用的医疗技术
对安全性、有效性确切,但是技术难度大、风险高,对医疗机构的服务能力、人员水平有较高要求的医疗技术,如:造血干细胞(包括脐带血造血干细胞)移植治疗血液系统疾病技术,质子、重离子加速器放射治疗技术,放射性粒子植入治疗技术(包括口腔颌面部恶性肿瘤放射性粒子植入治疗技术),肿瘤深部热疗和全身热疗技术,肿瘤消融治疗技术,心室辅助装置应用技术,颅颌面畸形颅面外科矫治术,口腔颌面部肿瘤颅颌联合根治术,人工智能辅助诊疗、治疗技术等;
存在重大伦理风险,需要严格管理的医疗技术,如:同种胰岛移植治疗糖尿病技术,同种异体组织移植治疗技术(仅限于角膜、骨、软骨、皮肤移植治疗技术),性别重置技术等;
纳入原省第二类医疗技术管理的技术,包括:冠心病介入诊疗技术,先天性心脏病介入诊疗技术,心脏导管消融技术,起搏器介入诊疗技术,角膜移植技术,白内障超声乳化技术,准分子激光角膜屈光手术,腹膜透析技术,临床基因扩增检验技术,医用高压氧治疗技术,三级以上介入诊疗技术,人工髋关节置换技术,人工膝关节置换技术,内镜诊疗技术等;医疗机构开展的属我省首次开展的医疗技术。
需要限定条件的医疗技术的目录根据医疗技术临床应用的发展,由国家和省卫生计生委制定、公布。
附件3限制临床应用医疗技术备案说明
登陆广东省医政管理平台(http://yz.gdwst.gov.cn:9090),在医疗机构管理模块的医疗技术管理菜单中按要求提示完成医疗技术备案,并上传医疗技术备案登记表和医师开展医疗技术临床应用备案登记表。
医疗机构账号密码由医疗机构的上级卫生计生行政部门下发。
3、各级卫生计生行政部门负责下辖医疗机构账号的分配。分配方法请在以下地址中下载《广东省医政综合管理信息系统操作指引_账号分配》。
(http://yz.gdwst.gov.cn:9090/yzzhgl/open/openfile.xhtml)。系统支持电话:020-85574999-8034。
4、各市及县(市、区)卫生计生局(委)的账号已由系统产生,详见账号清单(附表3)。默认密码:yz123456,登录后请及时修改密码。
来源:医谷网
为你推荐
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
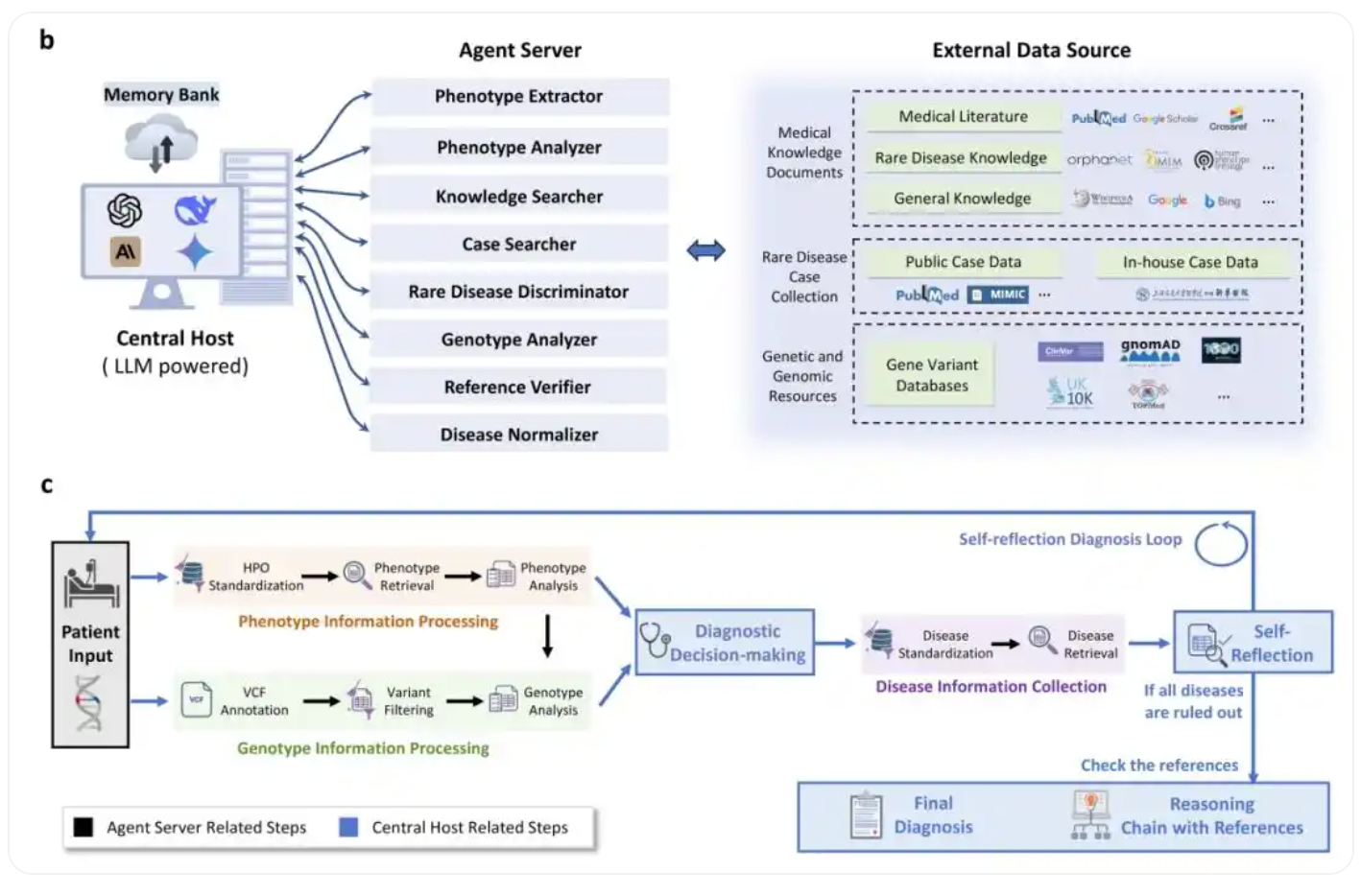
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42
 资讯
资讯 礼来ACHIEVE-3完整数据公布:orforglipron在头对头研究中优于口服司美格鲁肽
2026年2月26日,礼来正式公布了ACHIEVE-3研究的完整数据。该研究结果同步发表于国际权威医学期刊《柳叶刀》。
2026-02-27 11:38
 资讯
资讯 诺和诺德大幅下调司美格鲁肽价格
近日,诺和诺德宣布,将将大幅下调美国的司美格鲁肽药物官方标价(批发采购成本)其中减重版司美格鲁肽Wegovy降幅度50%,降糖版Ozempic降幅约35%。
2026-02-26 13:37
 资讯
资讯 新版《鼓励进口服务目录》发布,生命健康领域有哪些?
2月25日,商务部等七部门联合发布新版《鼓励进口服务目录》,目录主要包含研发设计服务、节能环保服务、环境服务、咨询服务、其他专业服务和医疗与健康服务六大板块。
2026-02-26 11:29
 资讯
资讯 长春高新一项拟用于改善特发性原因导致儿童小阴茎的临床试验获批
2月24日晚间,长春高新(000661 SZ) 发布公告称,旗下核心子公司金赛药业自主研发的GenSci141软膏(双氢睾酮软膏) 正式获得国家药监局临床试验批准通知书。
2026-02-25 22:32