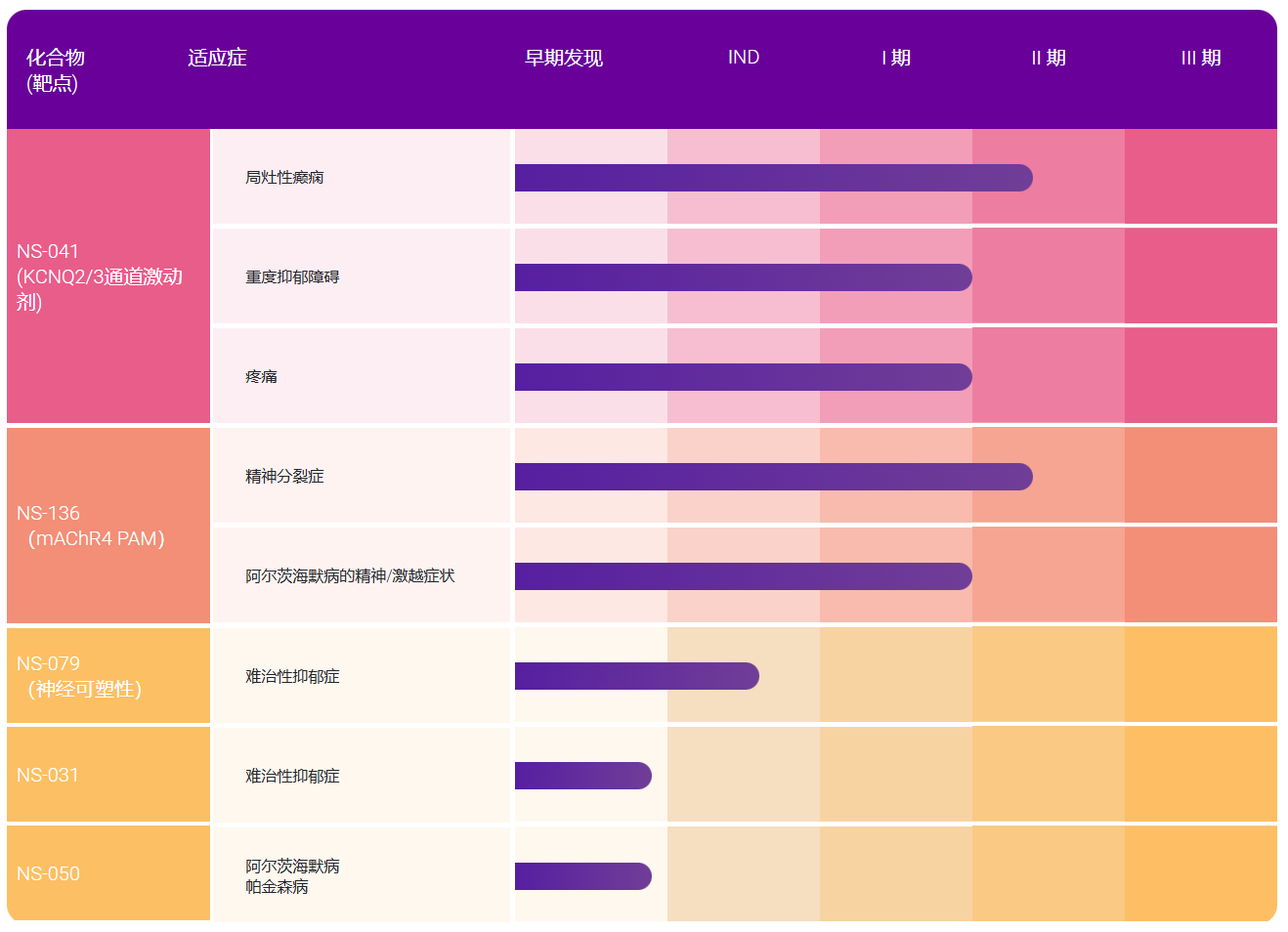
印度制药企业凭借较早的国际化经营意识和较强的仿制药开发能力,在欧美市场占据了较为明显的领先优势。据统计,仅在2017-2018年间,印度药品出口额为173亿美元,其中75%是药品制剂与生物药品,合计总额达129亿美元,60%出口至欧美等高端市场。
去年以来,中国国内一系列药监和集采新政的改革实施,为印度仿制药进入中国市场创造了越来越有利的条件,同时也不可避免地给国内医药市场带来冲击和变化,在看到国外仿制药为国内竞争体系注入新鲜血液的同时,国产仿制药如何与之正面交锋?
印度仿制药在中国:
发展较缓慢
由于中国仿制药市场竞争激烈,对通过一致性评价的进口仿制药使用倾斜性政策有限,大量获得欧美认证的印度仿制药对中国市场一直未深入涉足,市场份额更是微乎其微。曾任印度鲁宾(Lupin)制药公司驻中国业务代表Vijay先生写过一篇名为《为何印度制药企业不能在中国成功》的评述,认为致使印度制药企业难以进入中国的因素主要源于三方面:
一是对中国市场认识存在偏见,认为运营棘手;二是自我感觉良好,没有尽全力去尝试;三是高层管理人员关注度不够,对团队激励不足。由此导致的直接后果是,印度制药企业投资中国来去匆匆,且主要是原料药,制剂市场涉足很少。南新(Ranbaxy)放弃在内地的合资公司股份、瑞迪(DRL)总为昆山投资纠结、阿拉宾度(Aurobindo)和兰花(Orchid)在中国的合资经营昙花一现等就是真实写照。
市场准入新政:
利好进口仿制药
欧美注册的进口仿制药渐进“东风季”。去年以来,一系列药监和集采新政改革,为印度仿制药进入中国创造了越来越有利的条件。
2018年4月,国务院办公厅印发《关于改革完善仿制药供应保障及使用政策的意见》,明确提出促进仿制药研发,制定鼓励临床急需的仿制药品目录,加强仿制药技术攻关;加快推进仿制药质量和疗效一致性评价工作;完善支持政策,促进仿制药替代使,推动仿制药产业国际化,鼓励境外企业在我国建立研发中心和生产基地。5月,国家药监局、卫健委发布《关于优化药品注册审评审批有关事宜的公告》。7月,国家药监局发布《接受药品境外临床试验数据的技术指导原则》,“对于按照ICH和GCP管理规范,在境外开展仿制药研发,具备完整可评价的生物等效性数据的”,将有条件地包含在国内注册所承认的境外临床试验数据。12月,国家组织药品带量集采招标“4+7”城市试点实施,通过一致性评价的仿制药借助价格优势中标,临床替代原研药加快。进口仿制药对应的原研厂家在中国或日本已经上市的产品将有可能优先获批,从而推动过期原研药进一步降价。具有临床价值和价格竞争优势的印度仿制药,有望实现加快进口和赢得国内市场先机。
印度进口仿制药申报:
开始发力
据咸达统计,2016年以来,申报5.2类仿制药进口最多的国家和地区首位是印度,其次是瑞士,再次是中国台湾地区和希腊。申报产品最多的企业为印度瑞迪,申报产品包括治疗罕见贫血症的地拉罗司分散片、治疗难治性前列腺癌的醋酸阿比特龙片、治疗乳腺癌的氟维司群注射液、抗凝药利伐沙班片、治疗慢性肾病高磷血症的碳酸司维拉姆片等。
对于临床急需的治疗肿瘤等重症或罕见病的重磅仿制药,在中美贸易摩擦可能久拖不决的大背景下,中国对印度优先开发、获批欧美注册的重磅仿制药的进口需求会不断增加。
2018年底,国内临床试验默许制实施,进口仿制药进入备案制时代。“4+7”后,印度制药企业也看到了进军中国市场的巨大潜力,若获得加快进口审批和集采中标的新机会,将扩大印度仿制药国际化营收,同时减轻其参与美国市场销售竞争带来的压力。
国际化竞争:
积极应对
中国作为仅次于美国的全球第二大药品市场,日益增长的健康需求促使印度制药企业不得不重新审视中国用药的巨大潜力。特别是对于国内还未上市的临床急需的首仿药或技术壁垒高、市场需求大、竞品较少的仿制药,印度药品具有比较优势。
诚然,印度仿制药进入中国市场,不可避免会地给国内医药市场带来冲击和变化:
一是推动原研药价格下降,为国内竞争体系注入新鲜活力的“血液”。
二是提高国产仿制药动力,助推医药行业洗牌,加快药企仿创、转型升级发展。
三是满足临床多元化需求,减轻患者医疗负担,造福民众健康需求。
但说到底,进口仿制药的竞争力最终取决于具体品种的技术壁垒、销售价格、需求量、厂家数和国内准入政策改革力度等综合因素。进口仿制药生物等效性研究备案制下可否豁免,审批时限能够缩短多少,以及过度依赖进口的仿制药可能影响国内药品供应保障安全等问题,都是影响进口仿制药市场发展进程的重要因素。
随着仿制药市场国内竞争国际化、国际竞争国内化的趋势渐成,欧美注册、临床急需的仿制药进口潮涌,国产仿制药宜未雨绸缪,快马加鞭超越——特别是要聚焦临床急需,抢仿治疗重大疾病、老年慢病、妇儿及罕见病用药;开发缓控释、透皮吸收、粘膜吸收和气雾剂等高技术壁垒仿制药;延伸仿制药上游原辅料生产成本优势和下游制剂剂型创新能力,并升级药品内在的技术质量和外在的产业链差异化竞争速度。
来源:医药经济报 作者:朱军生
为你推荐
 资讯
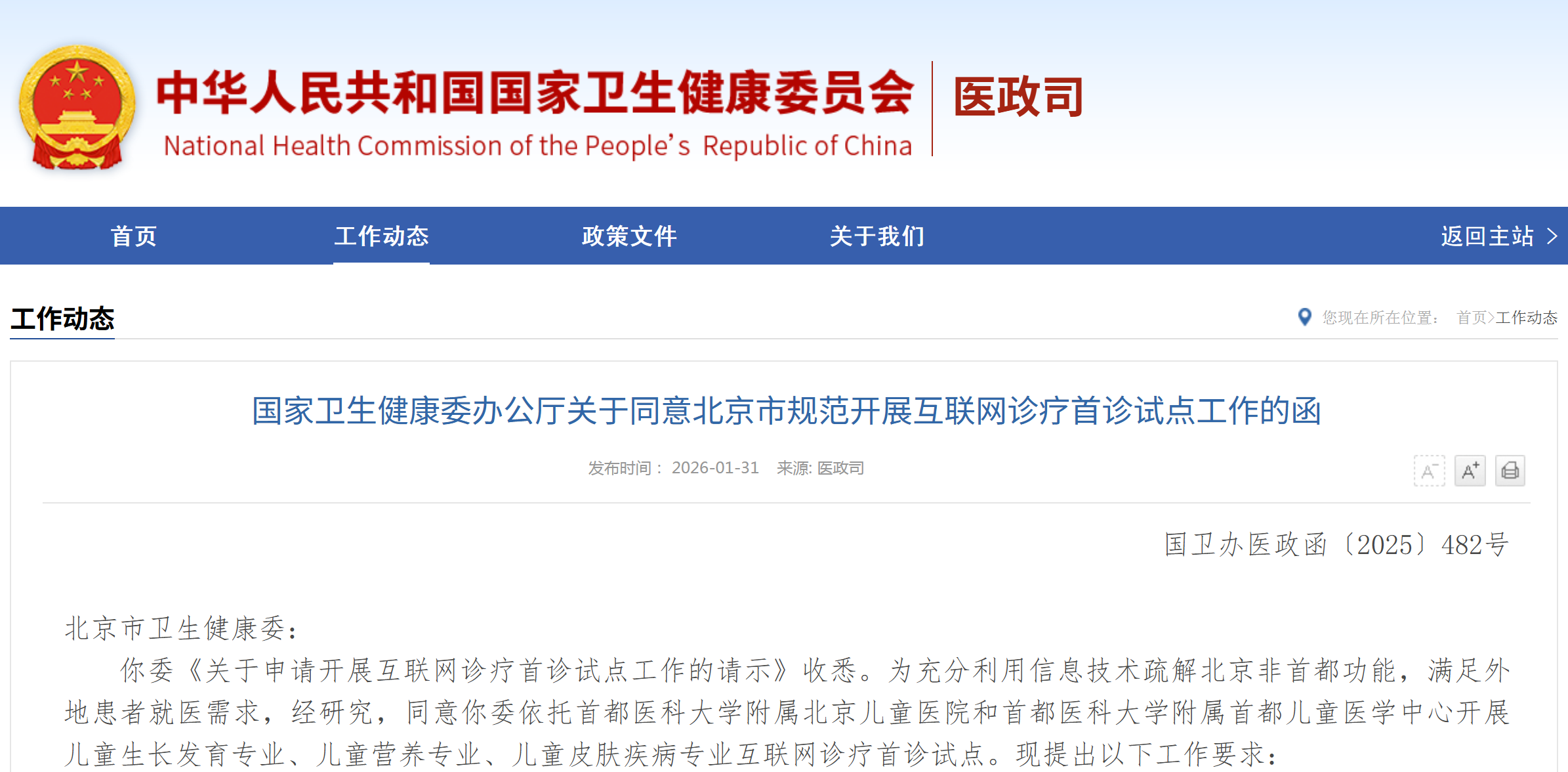
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
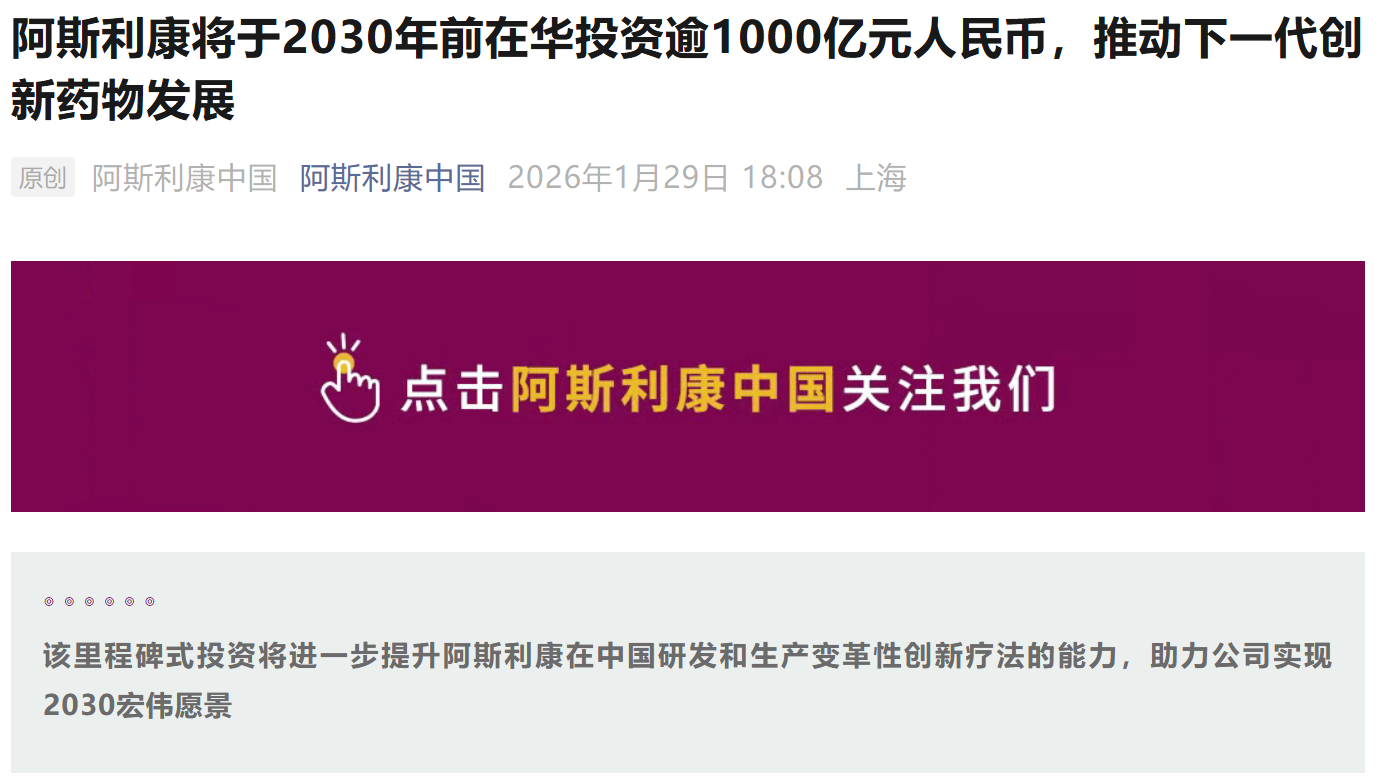
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
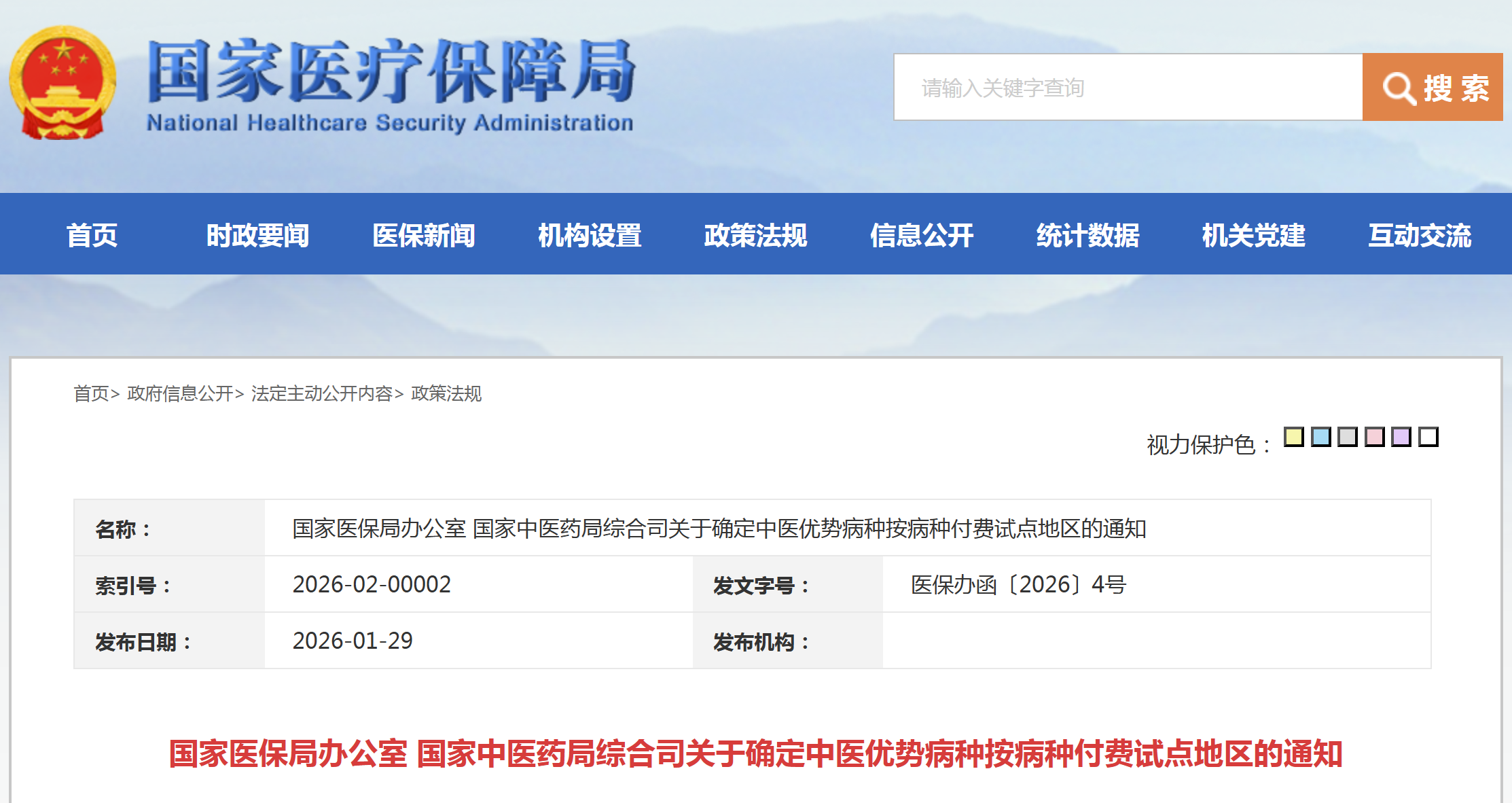
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
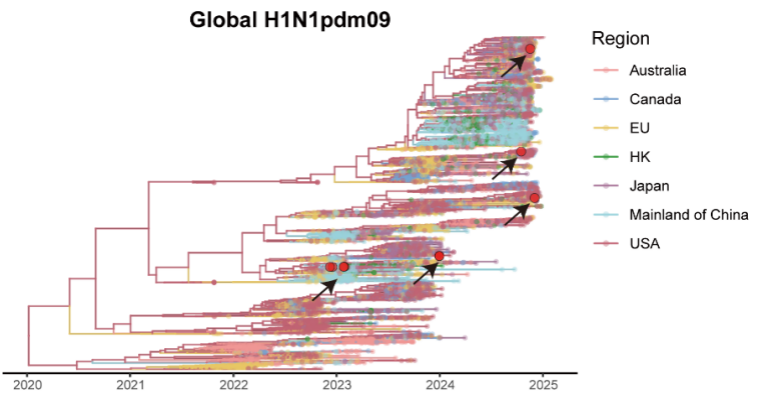
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22