近日,华东医药发布公告称,其全资子公司中美华东提交的人胰高血糖素样肽-1(GLP-1)受体激动剂利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请已获得国家药监局受理,值得一提的是,目前国内尚无申报利拉鲁肽肥胖适应症的企业,中美华东为国产首家。
原研减重适应症尚未在华获批
近年来,GLP-1受体靶点正在成为减重药研发的主流方向,据了解,GLP-1是人胰高血糖素基因分泌的一种蛋白质,广泛存在分布于全身多个器官和组织,可以促进人体胰岛素的分泌,起到降低血糖的功效,正是凭借良好的降糖效果,GLP-1受体激动剂已成为糖尿病领域崛起的中坚力量,但其带给人的惊喜不仅局限于降糖,还可以调节患者胃口,通过抑制食欲来降低体重实现减肥,已有临床应用证明了其良好的减重效果和安全性优势。
利拉鲁肽作为一款GLP-1受体激动,与人GLP1具有97%的序列同源性,临床主要用于改善成年人2型糖尿病(T2DM)的血糖控制,在国外也被获批用于肥胖或体重超重患者的治疗,该药的原研企业是诺和诺德,2009年、2010年和2011年,利拉鲁肽分别获得获欧洲药品管理局(EMA)、美国FDA和原国家食品药品监督管理局批准上市(现国家药品监督管理局)的批准上市,适应症均为糖尿病,英文商品名为Victoza,中文商品名为诺和力。
2014年利拉鲁肽的用于肥胖或超重适应症获得FDA批准,商品名为Saxenda,这也是FDA批准的首个GLP-1受体激动剂用于减肥适应症,其三期临床结果显示,60%的肥胖症患者注射利拉鲁肽后体重下降5%,而三分之一患者体重的降幅能达到10%。2015年,利拉鲁肽用于减重的适应症又获得了EMA的批准,截止目前,这一适应症目前尚未在国内获批。
2017年,利拉鲁肽通过谈判首次被纳入国家医保目录2017年版,并续约纳入国家医保目录2019年版、2020年版及2021年版。
根据诺和诺德的定期报告,2019~2021年,诺和诺德利拉鲁肽注射液全球销售额业绩分别为219.34亿丹麦克朗、187.47亿丹麦克朗、150.54亿丹麦克朗,其中国市场销售额业绩分别为8.98亿丹麦克朗、10.33亿丹麦克朗及15.44亿丹麦克朗。
另据西南证券研究报告统计,2019年利拉鲁肽PBD销售额达到2.2亿元,占我国GLP-1市场份额为92%。2021年,利拉鲁肽凭借14.94亿元的销售业绩,占据中国GLP-1市场绝对垄断地位。
产品是买的非自研
根据华东医药公告,其利拉鲁肽注射液为原研的生物类似药,生产工艺与原研厂家不同。值得注意的是,华东医药的利拉鲁肽也并非自研,而是买来的。
2017年8月,中美华东以8000万元受让杭州九源基因工程有限公司拥有的利拉鲁肽新药技术,根据《新药技术转让合同》,中美华东成功受让利拉鲁肽新药技术并上市后的前6年里,每年需按其相关产品销售净额的3%提取并支付给杭州九源基因工程有限公司技术使用费。截至2021年12月31日,中美华东已累计支付新药技术转让款合计7200万元,加上研发投入的2.87亿元,在利拉鲁肽上已投资超3.5亿元。
为了尽快收回成本,推动产品的商业化上市,此前,中美华东已向国家药监局提交了利拉鲁肽用于糖尿病的适应症上市许可申请,并于2021年9月获得受理,有望于今年底前获批上市。
而此次利拉鲁肽提交的肥胖或超重适应症的药品注册申请是依据两项试验结果,其一为一项随机、开放、两周期、自身交叉对照试验设计的I期试验,用于评价利拉鲁肽注射液与诺和力在中国健康受试者中药动学和安全性的比对研究;其二为一项多中心、随机、双盲、安慰剂平行对照的III期临床试验,用于评价利拉鲁肽注射液辅助生活方式干预治疗肥胖,或超重伴并发症的成年非糖尿病患者疗效和安全性,不过,对于该两项试验的具体数据,华东医药并未在公告中披露。
糖尿病和减重适应症的双申请有望使中美华东成为国内首家利拉鲁肽获批两个适应症的企业。产品还未获批上市,商业布局已先行一步,今年6月23日,中美华东与中东知名企业Julphar达成战略合作,授予Julphar利拉鲁肽注射液糖尿病和减肥两个适应症在阿联酋、沙特阿拉伯、埃及、科威特、阿曼、巴林等中东和北非地区17个国家的开发、生产及商业化权益。
还有多家国内企业在角逐
近年来,随着经济快速发展和人们生活水平的改善,我国肥胖患者数量显著增加,据《中国居民营养与慢性病状况(2020)》报告显示,有超过50%的成年居民超重或肥胖,6-17岁、6岁以下儿童超重/肥胖率分别达到19%和10.4%。超重和肥胖可显着增加心脑血管、唿吸、内分泌、消化、运动、生殖及精神等多系统疾病风险甚至严重影响生活质量。根据国家药品监督管理局药品审评中心(CDE)于2021年12月发布的《体重控制药物临床试验技术指导原则》,我国目前仅有奥利司他胶囊一种药物获批用于肥胖或体重超重患者的治疗,在相关平台上,关于奥利司他疗效有限、副作用较大的评论也较多,由此可看出,合规、安全及有效的体重控制药物存在巨大未被满足的临床需求。
极具发展潜力的市场也引来了国内企业的争相布局,除了华东医药,根据万联证券今年5月中旬发布的报告显示,目前国内处于临床试验阶段的含GLP-1受体激动剂的体重管理药物的创新药在研产品共有8款,其中3款处于三期临床试验阶段,3款处于二期临床试验阶段,2款处于一期临床试验阶段。此外,还有3款利拉鲁肽仿制产品处于临床试验阶段。
今年6月,信达生物宣布其mazdutide在中国超重或肥胖受试者中的一项随机、双盲、安慰剂对照的II期临床研究达到了主要临床终点和所有的关键次要临床终点,研究结果显示,mazdutide各剂量在中国超重或肥胖受试者中展现出显著的减重疗效,且呈现剂量依赖性。同时,mazdutide还可明显降低体重指数、腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量等,改善胰岛素敏感性。安全性方面,mazdutide耐受性良好。
来源:医谷网
为你推荐
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈®)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
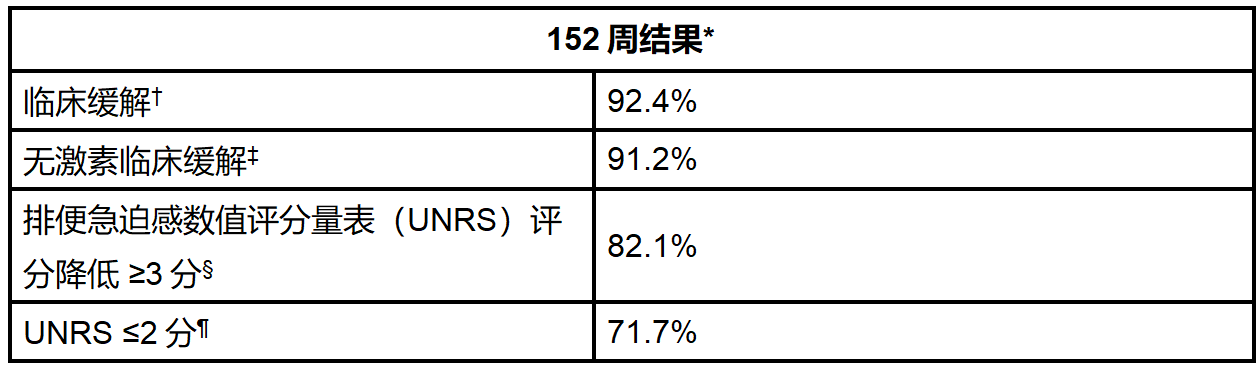 资讯
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54








