12月26日,来自美国抗体协会等机构的4位科学家在mAbs上发表了题为“Antibodies to watch in 2020”的年度报告[1]。报告汇总分析了2019年在美国和欧盟监管下获批的抗体疗法,以及截至2019年11月处于后期临床研究的候选抗体药物。
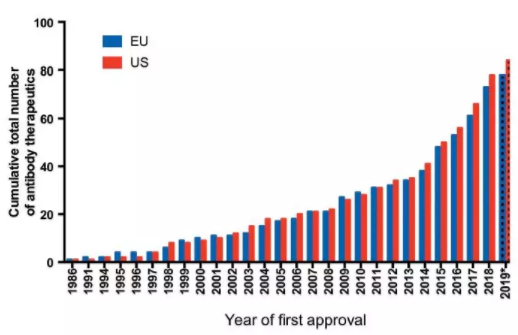
图1 1986–2019年,在美国或欧盟首次获批的抗体疗法的累积数量(图片来源:mAbs)
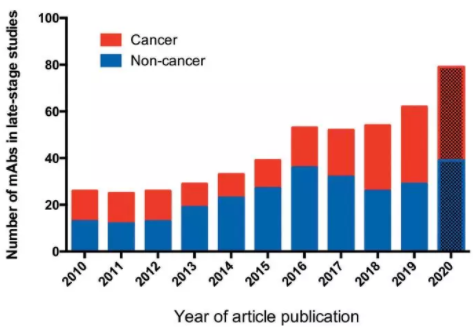
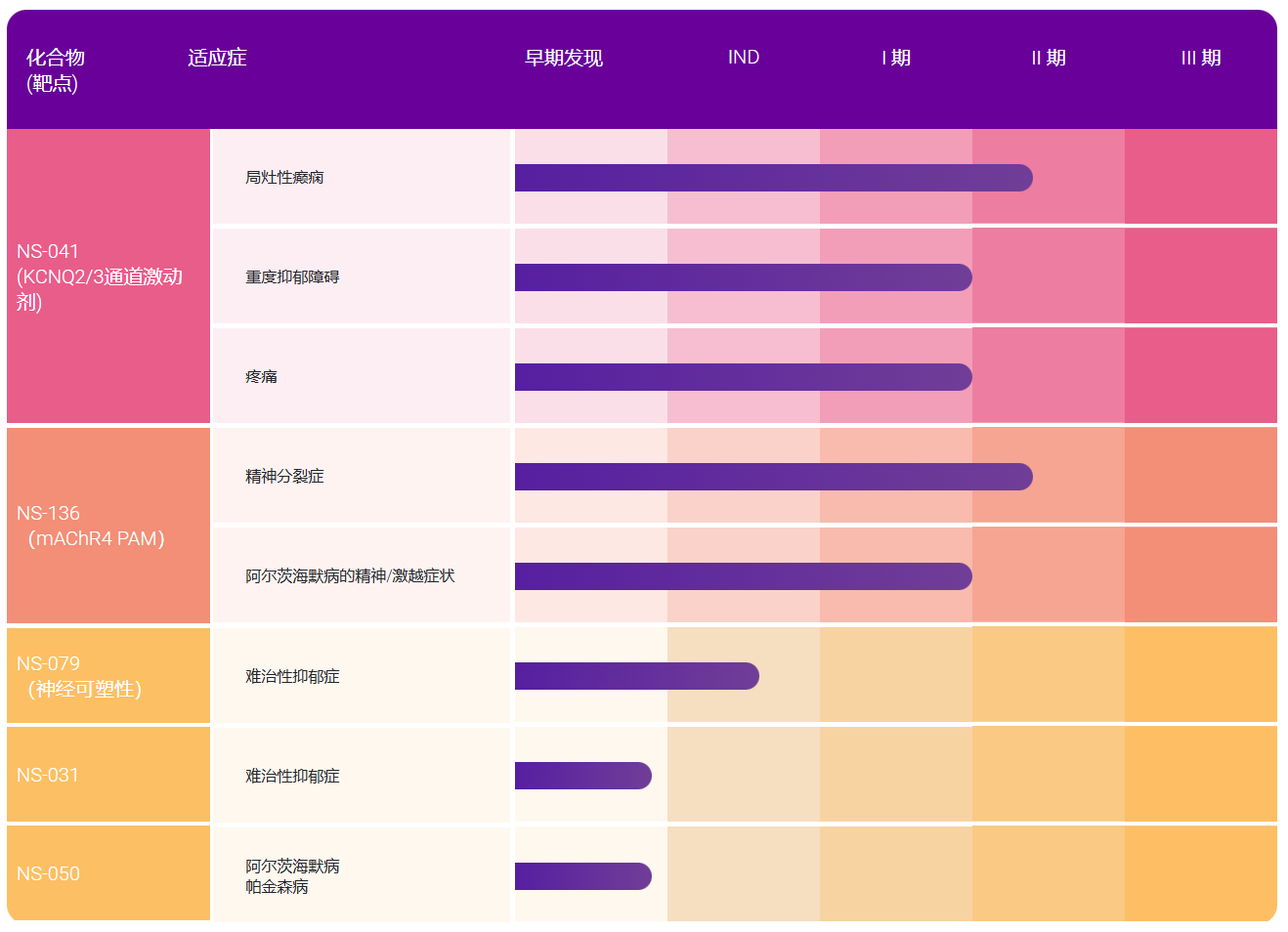
报告称,2010-2019年,抗体疗法的开发取得了实质性进展,2019年累计上市的抗体数量是2010年的近3倍(图1)。此外,目前,后期临床管线非常丰富,与2010年相比,处于后期研究阶段的抗体疗法数量增加了两倍多(图2);同时早期临床管线也非常“热闹”,至少有500多种新型抗体疗法处于临床I、I/II、II期。
图2 处于后期临床研究的抗体疗法(图片来源:mAbs)
以下是报告部分内容摘编:
一、2019年首次在美国或欧盟获批的抗体疗法
截至2019年11月,共有5款新型抗体疗法在美国或欧盟首次获批,包括romosozumab、risankizumab、polatuzumab vedotin、brolucizumab和crizanlizumab(表1)。这是自2013年(仅2款新抗体疗法在美国和欧盟获批)以来获批数量最低的一年。
表1 2019年在美国或欧盟首次批准的抗体疗法
注:报告统计时间截至2019年11月,未含12月获批的产品(数据来源:mAbs)
资料补充:截至2019年12月31日,美国FDA共批准了4款单抗(romosozumab, risankizumab、brolucizumab和crizanlizumab)、3款抗体药物偶联物(polatuzumab vedotin、enfortumab vedotin 、trastuzumab deruxtecan )、1款纳米抗体(caplacizumab-yhdp)、1款融合蛋白(luspatercept )[2]。
Romosozumab
公司:Amgen、Astellas
Romosozumab (AMG785, EVENITY)是一种IgG2人源化单克隆抗体,可结合和抑制由骨细胞分泌的硬化蛋白(sclerostin),于2019年1月在日本率先获批用于治疗骨折高危患者的骨质疏松症;同年4月,FDA批准了romosozumab-aqqg用于绝经后骨折高危妇女的骨质疏松症治疗。该药的安全性和有效性在FRAME (NCT01575834) 和ARCH (NCT01631214)两项III期试验中得到了证实。同年12月,EMA也批准了该药上市。
Risankizumab
公司:Boehringer Ingelheim、AbbVie
Risankizumab (Risankizumab -rzaa, SKYRIZ)是一种人源化的IgG1单抗,通过与p19亚基结合抑制IL-23(一种参与炎症过程的细胞因子)。该药于2019年4月在日本首次获批用于治疗成人斑块型银屑病、泛发性脓疱型银屑病、红皮病型银屑病和银屑病关节炎。一个月后,美国和欧盟先后批准了该药。
Polatuzumab vedotin
公司:Genentech
2019年6月,FDA加速批准了Polivy(polatuzumab vedotin-piiq) 联合化疗药物苯达莫司汀和利妥昔单抗治疗成人弥漫性大b细胞淋巴瘤(DLBCL)。Polivy由人源化cd79b IgG1抗体偶联抗有丝分裂药物monomethyl auristatin E (MMAE)组成。cd79b在淋巴瘤患者的B细胞上高表达。去年11月,EMA的人类用药委员会(CHMP)建议有条件批准Polivy治疗复发/难愈性弥漫性大B细胞淋巴瘤,欧盟委员会的决定通常在CHMP给出建议后67天内公布。
Brolucizumab
公司:Novartis
2019年10月,FDA批准brolucizumab-dbll (BEOVU)用于治疗新生血管性年龄相关性黄斑变性(nAMD)。Brolucizumab是一种人源化抗体单链可变区片段(single-chain variable fragment, scFv),可与人血管内皮生长因子(VEGF)的3种主要亚型结合,从而干扰它们与受体VEGFR-1和VEGFR-2的相互作用,抑制内皮细胞的增殖、新生血管形成和血管通透性。EMA正在审查brolucizumab的上市申请。
Crizanlizumab
公司:Novartis
Crizanlizumab (Adakveo)是一种直接靶向P-selectin(与镰状细胞病的发病有关)的人源化抗体。2019年11月,FDA批准了crizanlizumab作为一种降低血管阻塞性危像(VOC)频率的治疗药物。对≥16岁的患者来说,当血液循环被镰状红细胞阻塞时就会发生VOC。EMA目前暂未批准该药。
二、正在美国或欧盟接受监管审查的抗体疗法
根据截至2019年11月的可用公开信息,美国或欧盟正在审查共13种新型抗体疗法的上市申请(BLA或上市授权申请[MAA])(表2),包括Eptinezumab、teprotumumab、enfortumab vedotin、isatuximab、[fam-] trastuzumab deruxtecan、inebilizumab、leronlimab、sacituzumab govitecan、satralizumab、narsoplimab、tafasitamab、REGNEB3、naxitamab。以下是每种抗体的简要概述。
表2 正在欧盟或美国接受监管审查的在研抗体疗法
注:统计截至2019年11月,部分信息已更新,如抗体药物偶联物Enfortumab vedotin和[fam-] trastuzumab deruxtecan已于2019年12获批上市。(数据来源:mAbs)
Eptinezumab
公司:Alder BioPharmaceuticals
与已上市的单抗fremanezumab和galcanezumab一样,eptinezumab靶向降钙素(calcitonin)基因相关的肽,被开发用于偏头痛患者。FDA已经接受了eptinezumab的BLA,PDUFA日期为2020年2月21日。III期试验PROMISE 1 (NCT02559895) 和PROMISE 2 (NCT02974153)调查了eptinezumab对阵发性和慢性偏头痛的预防作用。试验数据支持了该药的BLA申请。
Teprotumumab
公司:Horizon
Teprotumab(HZN-001)是一种以胰岛素生长因子1受体为靶点的全人源IgG1单抗,被开发用于中度至重度甲状腺眼病(TED,可导致眼球突出、斜视、复视和失明)的治疗。Teprotumumab已被FDA授予快速通道、突破性疗法和孤儿药认定。根据Ⅱ期(NCT01868997)和Ⅲ期(NCT03298867)研究的阳性数据,Horizon向FDA提交了Teprotumab作为TED疗法的BLA,PDUFA日期为2020年3月8日。
Enfortumab vedotin
公司:Seattle Genetics、Astellas
Enfortumab vedotin (ASG22ME) 是一种抗体药物偶联物(ADC),由靶向Nectin-4蛋白(一种尿路上皮癌中高表达的靶点)的抗体与MMAE偶联而成。Enfortumab vedotin于2018年3月被FDA授予治疗局部晚期或转移性尿路上皮癌的突破性疗法认定,其BLA也获得了优先审查资格,PDUFA日期为2020年3月15日。2019年12月,该药已经获FDA批准上市。
Isatuximab
公司:Sanofi
Isatuximab(SAR650984)是赛诺菲公司开发的一种抗CD38 IgG1嵌合单抗,被开发用于治疗多发性骨髓瘤(MM)。EMA已经接受了isatuximab用于治疗难治性多发性骨髓瘤(RRMM)的MAA,FDA也已接受该药的BLA,审批决定最晚于2020年4月30日公布。
[fam-] Trastuzumab deruxtecan
公司:AstraZeneca、DaiichiSankyo
[fam-] Trastuzumab deruxtecan(DS-8201a)是一种ADC,由抗人表皮生长因子2(HER2)人源化抗体与一种有效的拓扑异构酶I抑制剂偶联而成,被开发用于HER2阳性转移性乳腺癌等癌症的治疗。2019年10月,阿斯利康和第一三共宣布FDA接受了trastuzumab deruxtecan用于治疗HER2阳性转移性乳腺癌的BLA,并授予了优先审查资格。去年12月,该药已获FDA批准上市。
Inebilizumab
公司:Viela Bio
Inebilizumab(MEDI-551)是由Viela Bio开发的人源化抗CD19单克隆抗体,用于治疗视神经脊髓炎谱系疾病(NMOSD)。2019年8月,Viela Bio宣布,基于Ⅱ/Ⅲ期N-Momentum试验(NCT02200770)的安全性和有效性结果,FDA接受了inebilizumab的BLA。该药先前曾获FDA授予突破性疗法以及孤儿药认定。EMA也授予了inebilizumab孤儿药认定。
Leronlimab
公司:CytoDyn
Leronlimab(PRO140)是一种人源化IgG4单克隆抗体,靶向趋化因子受体5(CCR5),该受体与多种病理生理过程有关,如HIV-1进入CD4 + T细胞、肿瘤侵袭和转移、非酒精性脂肪肝(NASH)发病、急性移植物抗宿主病(GvHD)发展。
2019年3月,CytoDyn宣布提交了leronlimab与高活性抗逆转录病毒疗法联合治疗HIV阳性患者BLA的第一部分资料,并预计在2019年底提交其余部分。除了HIV,该公司正在临床试验中评估leronlimab治疗转移性结直肠癌(mCRC)、NASH、转移性三阴性乳腺癌(TNBC)和急性GvHD的安全性和有效性。
Sacituzumab govitecan
公司:Immunomedics
Sacituzumab govitecan是一种ADC,由SN38(拓扑异构酶I抑制剂irinotecan的活性代谢物)与抗Trop 2抗体偶联而成。Trop-2在包括TNBC在内的大多数上皮癌中高度表达。根据I/II期数据,Immunomedics正在寻求sacituzumab govitecan治疗TNBC的加速批准。FDA先前授予了sacituzumab govitecan针对该适应证的突破性疗法和快速通道认定。
2018年7月,FDA接受了sacituzumab govitecan的BLA,用于治疗既往接受过至少2种疗法治疗的mTNBC患者,并授予优先审查。2019年1月,FDA发布了一份完整的回复函,详细说明了与批准有关的问题。2019年12月,Immunomedics宣布重新提交了BLA。
Satralizumab
公司:Chugai Pharmaceutical
Satralizumab是一种以pH依赖的方式结合IL-6受体的人源化抗体,目前正在接受EMA的审查。该药有望抑制NMOSD(一种罕见的终生自身免疫性疾病,其特征是视神经和脊髓的炎症性病变)的复发。Satralizumab被FDA、EMA和日本MHLW授予了孤儿药认定。FDA还授予了satralizumab治疗NMOSD的突破性疗法认定。
Narsoplimab
公司:Omeros
Narsoplimab(OMS721)是一种以甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2)为靶点的全人源IgG4单抗。MASP-2与补体介导的疾病有关,如血栓性微血管病(TMAs),包括造血干细胞移植(HSCT)相关的TMA和非典型溶血性尿毒症综合征(aHUS)。FDA先前曾授予narsoplimab治疗HSCT-TMA的突破性疗法和孤儿药认定。Omeros于2019年10月开始滚动提交narsoplimab治疗HSCT-TMA的BLA。同时,该公司也在准备向EMA提交MAA。
Tafasitamab
公司:Morphosys AG
Tafasitamab又称MOR208,是一种靶向CD19的Fc工程化IgG1单抗,CD19在弥漫性大B细胞淋巴瘤(DLBCL)和慢性淋巴细胞白血病(CLL)等B细胞恶性肿瘤中表达。Tafasitamab的开发主要集中在治疗难治性DLBCL复发患者,已获FDA授予的突破性疗法和快速通道认定,并同时获得了FDA和EMA授予的孤儿药认定。2019年10月,MorphoSys开始向美国FDA滚动提交BLA,并希望在年底完成申请。向EMA递交MAA也在计划中。
REGNEB3
公司:Regeneron
REGNEB3是3种全人源IgG1单抗(REGN3470、REGN3471和REGN3479)的混合物,它们结合埃博拉病毒糖蛋白(GP)上的不同表位。REGNEB3已被FDA授予突破性疗法认定,Regeneron已经开始滚动提交BLA。REGN-EB3也被FDA和EMA授予了孤儿药资格。
Naxitamab
公司:Y-MABS Therapeutics
Naxitamab(hu3F8)是一种靶向disialoganglioside GD2的人源化IgG1抗体,disialoganglioside GD2在许多肿瘤中表达,如神经母细胞瘤、黑色素瘤、骨和软组织肉瘤和小细胞肺癌。
Naxitamab在欧盟和美国获得了治疗神经母细胞瘤的孤儿药认定,并获得了FDA授予的突破性疗法认定。2019年11月,Y-MABS Therapeutics宣布基于I/II期研究12–230 (NCT01757626)和关键II期研究201 (NCT03363373)启动naxitamab的滚动BLA,用于治疗复发/难治性高危神经母细胞瘤。
三、2020年值得关注的抗体:非癌症适应证
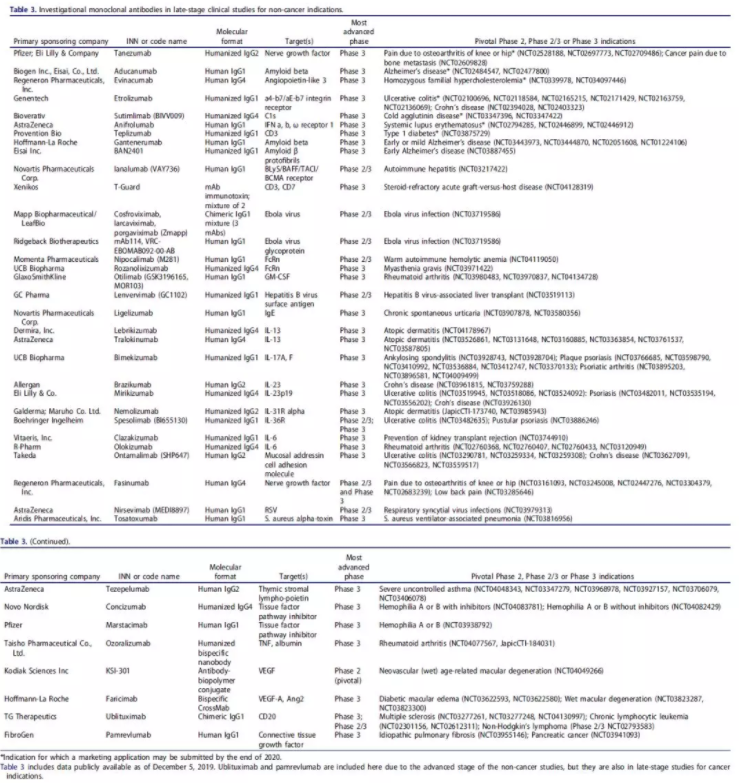
根据截至2019年11月的公开信息,目前39种抗体疗法正在后期研究中接受评估,用于非癌症适应证(表3)。其中,7种新型抗体疗法的开发商称,他们可能在2020年递交BLA或MAA,包括tanezumab、aducanumab、evinacumab、etrolizumab、sutimlimab、anifrolumab和teplizumab。
表3 适应证非癌症、处于后期临床研究的在研抗体疗法
数据来源:mAbs
Tanezumab
公司:Pfizer、Eli Lilly
Tanezumab是选择性靶向神经生长因子的人源化IgG2抗体。与阿片类药物和其他止痛药(包括非甾体类抗炎药)相比,它具有新颖的机制。研究还表明,tanezumab尚未显示成瘾、滥用或依赖风险。FDA已授予tanezumab用于治疗骨关节炎(OA)疼痛和慢性下背部疼痛的快速通道认定。礼来和辉瑞计划在第一季度之前递交tanezumab治疗中至重度OA患者的BLA。
Aducanumab
公司:Biogen、Eisai
Aducanumab(BIIB037)是全人源抗β淀粉样蛋白(Aβ)IgG1单抗,被开发用于治疗早期阿尔茨海默症。2016年9月,FDA授予aducanumab快速通道认定。Aducanumab在两项针对早期阿尔茨海默症患者的III期试验(EMERGE [NCT02484547] 和ENGAGE [NCT02477800])中接受评估。根据与FDA的讨论,Biogen和Eisai计划在2020年初提交BLA。
Evinacumab
公司:Regeneron
Evinacumab是一种全人源IgG4抗体,可与血管生成素样蛋白3(ANGPTL3)特异性结合。FDA已授予evinacumab用于治疗家族性高胆固醇血症(HoFH)患者的突破性疗法认定。Regeneron表示,临床研究数据将在2020年提交给监管机构。
Etrolizumab
公司:Roche
Etrolizumab是一种人源化抗整合素IgG1抗体,被设计用于治疗中至重度炎症性肠病(如溃疡性结肠炎(UC))患者。目前有6项III期临床试验正在评估Etrolizumab在UC患者中的安全性和有效性。其中,HICKORY(NCT02100696)、LAUREL(NCT02165215)和GARDENIA(NCT02136069)这3项研究的主要完成日期是2020年4月。罗氏计划在今年提交etrolizumab治疗UC的监管申请。
Sutimlimab
公司:Sanofi
Sutimlimab(原名BIVV009)是一种人源化IgG4抗体,与免疫系统经典补体通路中C1复合物中的丝氨酸蛋白酶C1s结合,从而抑制冷凝集素疾病(CAD,一种难以治疗的罕见自身免疫性溶血性贫血)中溶血的主要机制。FDA已授予Sutimlimab治疗原发性CAD患者溶血的突破性疗法以及孤儿药认定。赛诺菲可能会在2020年提交sutimlimab治疗CAD的监管申请。
Anifrolumab
公司:Astra Zeneca
Anifrolumab(MEDI-546)是一种抗I型干扰素(IFN)α受体1(IFNAR1)全人源IgG1抗体。通过结合IFNAR1的亚基,该抗体可阻断IFN-α,IFN-β和IFN-ω的作用。Anifrolumab正在III期临床研究中进行评估,以治疗中至重度系统性红斑狼疮(SLE)。FDA已授予anifrolumab治疗SLE的快速通道认定。阿斯利康可能会在2020年下半年提交anifrolumab治疗SLE的监管申请。两项III期研究(TULIP1 [NCT02446912] 和TULIP2 [NCT02446899])正在评估anifrolumab的安全性和有效性。
Teplizumab
公司:Provention
Teplizumab(PRV-031)是Provention Bio开发的一种人源化Fc受体非结合型抗CD3 IgG1抗体,用于延迟或预防1型糖尿病(T1D)。FDA已授予teplizumab突破性疗法认定,EMA也授予了该药PRIME(Priority Medicines)认定。相关BLA申请有望在2020年第四季度提交。
四、2020年值得关注的抗体:癌症适应证
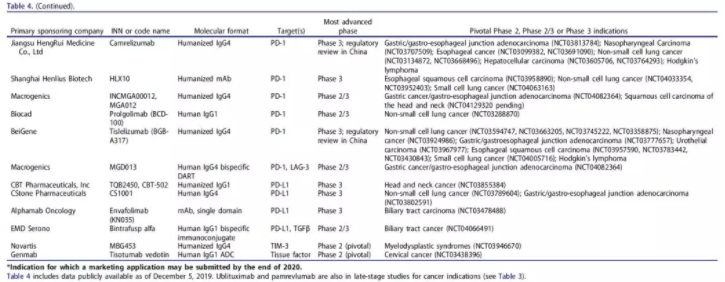
根据截至2019年11月的公开可用信息,共有40款抗体疗法正在后期临床研究中被用于治疗癌症(表4)。其中,9款新型抗体疗法的开发商表示,他们可能在2019年年末或2020年递交BLA或MAA,包括belantamab mafodotin、oportuzumab monatox、margetuximab、dostarlimab、spartalizumab、131I-omburtamab、loncastuximab tesirine、balstilimab和zalifrelimab。
表4 适应证为癌症、处于后期临床研究的在研抗体疗法
数据来源:mAbs
Belantamab mafodotin
公司:GlaxoSmithKline
Belantamab mafodotin也被称为GSK2857916,是一种ADC,由抗B细胞成熟抗原IgG1抗体与细胞毒性药物monomethyl auristatin F偶联而成,被开发用于治疗复发/难治性多发性骨髓瘤患者,已获得FDA授予的突破性疗法认定以及EMA的PRIME认定。此外,两个机构同时授予了该药孤儿药认定。GSK目前已递交上市申请。
Oportuzumab monatox
公司:Sesen Bio
Oportuzumab monatox (Vicinium, VB4-845)是一种由靶向EpCAM的人源化scFv和Pseudomonas exotoxin A组成的重组融合蛋白。该药靶向肿瘤细胞表面的EpCAM,使其内化,释放载荷外毒素(exotoxin)以诱导细胞凋亡。FDA已授予该药用于治疗BCG(bacillus Calmette-Guérin)无响应性非肌肉浸润性膀胱癌(NMIBC)的快速通道认定。目前,Sesen Bio已递交该药的上市申请。
Margetuximab
公司:Macrogenics
Margetuximab (MGAH22) 是一种嵌合抗HER2 IgG1抗体。FDA已授予该药治疗转移性或局部晚期HER2阳性乳腺癌患者(先前接受过抗HER2靶向治疗)的快速通道认定。基于III期研究SOPHIA (NCT02492711)的结果,开发商已向FDA递交BLA。
Dostarlimab
公司:GlaxoSmithKline/Tesaro、AnaptysBio
Dostarlimab (TSR-042)是一种人源化的IgG4抗体,可与PD-1受体结合,有效阻断其与配体PD-L1和PD-L2的相互作用,被开发用于治疗卵巢癌、子宫内膜癌等实体瘤。多项III期临床研究正在开展。
Spartalizumab
公司:Novartis
Spartalizumab(之前被称为PDR001)也是一款人源化IgG4 PD-1抗体,被开发用于治疗包括黑色素瘤在内的多种癌症。诺华预计在2020年提交spartalizumab联合dabrafenib和trametinib治疗转移性黑色素瘤的上市申请。
131I-omburtamab
公司:Y-mAbs Therapeutics
131I-Omburtamab(先前被称为8H9或burtomab)由一种靶向B7-H3抗原的鼠源IgG1抗体和碘-131组成,目前正在被开发用于治疗儿童中枢神经系统/柔脑膜转移(CNS/LM,一种罕见、通常致命的神经母细胞瘤并发症)患者。131I-Omburtamab已被FDA授予针对这一适应证的突破性疗法认定。Y-mabs Therapeutics预计将于2020年初开始滚动提交该药的BLA。
Loncastuximab tesirine
公司:ADC Therapeutics
Loncastuximab tesirine是一款ADC,由靶向CD19的人源化IgG1抗体与pyrrolobenzodiazepine (PBD)-二聚物毒素偶联而成,被开发用于治疗B细胞血液恶性肿瘤。FDA已授予该药治疗DLBCL和套细胞淋巴瘤的孤儿药认定。ADC Therapeutics预计在2020年第二季度报告关键II期试验(NCT03589469)的缓解率数据,如果试验成功,将在2020年下半年提交BLA。
Balstilimab、zalifrelimab
公司:Agenus
Agenus公司目前专注于开发balstilimab(AGEN2034)和zalifrelimab (AGEN1884)作为宫颈癌的二线治疗药物。Balstilimab是全人源IgG4抗PD-1抗体,zalifrelimab是全人源IgG1 CTLA-4抗体。根据Agenus预测,基于FDA的加速批准途径,I/II期研究的结果可能支持最早在2020年递交BLA。
五、遭遇挫折的抗体疗法
除了积极的进展,2019年也有一些抗体疗法的研发和上市遭遇了挫折,比如rovalpituzumab tesirine研发中止、Lartruvo撤市。
Rovalpituzumab tesirine
公司:AbbVie
Rovalpituzumab tesirine是一款ADC,由一种靶向DLL3的人源化IgG1抗体与细胞毒性pyrrolobenzodiazepine二聚物D6.5通过可断裂蛋白酶linker偶联而成。DLL3在小细胞肺癌细胞中过表达,该ADC的临床研究主要集中在这类癌症上。然而,研究结果显示,Rovalpituzumab tesirine的临床活性未达预期。III期研究MERU(NCT03033511)表明,与安慰剂相比,该药未给患者带来生存益处。MERU试验已关闭,其它相关研发项目终止。
Olaratumab
公司:Eli Lilly
Olaratumab(Lartruvo)是一种抗PDGFR-α(platelet-derived growth factor receptor alpha)抗体,2016年10月被FDA加速批准用于治疗晚期或转移性软组织肉瘤。然而,随后的验证性试验(III期临床研究ANNOUNCE)未能进一步证实Olaratumab的临床益处。2019年4月,礼来宣布,从市场上撤回Lartruvo。
六、2020年有望创造新记录
总结来说,报告预计,基于截至2019年12月已经在接受监管审查的抗体疗法数据,2020年首次获批的抗体数量可能会创造新的记录。
参考资料:
[1] Hélène Kaplon et al. Antibodies towatch in 2020. mAbs (2019).
[2] 2019 FDA drug approvals. Nature Reviews Drug Discovery (2020).
来源:医药魔方
为你推荐
 资讯
资讯 AI制药独角兽深度智耀完成6000万美元新一轮融资,加速全栈式研发解决方案落地
本轮融资吸引了信宸资本、金镒资本、凯泰资本等新投资方入局,老股东鼎晖百孚、新鼎资本持续追加投资
2026-02-03 20:03
 资讯
资讯 济川药业联合康方生物,共拓心血管创新药商业化新局
伊喜宁®(伊努西单抗注射液)是康方生物自主开发创新的PCSK9单克隆抗体新药,于2024年9月获批上市,用于治疗原发性高胆固醇血症和混合型高脂血症,包括杂合子家族性高胆固醇血...
2026-02-03 19:34
拜耳诺倍戈®第三项适应症在中国获批,用于治疗转移性激素敏感性前列腺癌(mHSPC)
诺倍戈®此前已先后获批用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者,和联合多西他赛治疗转移性激素敏感性前列腺癌的(mHSPC)成年患者。
2026-02-03 18:42
 资讯
资讯 又一款老花眼滴眼液获批,市场有待检验
近日,Tenpoint Therapeutics宣布,美国FDA已批准Yuvezzi(carbachol和brimonidine tartrate滴眼液,2 75% 0 1%),用于治疗成人老花眼。
2026-02-02 14:06
 资讯
资讯 深度缓解数据惊艳:基于诺奖机制的 CELMoD药物如何重塑 MM 治疗逻辑?
近期,国家药品监督管理局药品审评中心(CDE)将CELMoD药物 iberdomide (以下简称:IBER)纳入优先审评名单并启动优先审评程序,拟批准
2026-02-02 13:22
 资讯
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00