2016年8月9日,CFDA在其官网发布关于开展药品生产工艺核对工作的公告(征求意见稿),一石激起千层浪。
业内普遍认为,始于去年7月22日针对药企进行的临床试验自查核查风暴是监管趋严的发端,之后又出台仿制药一致性评价大招,现如今又开始了针对药企生产工艺的核对。这是想置药企于死地的节奏吗?
当然并非这样,从监管层的角度来看,政策的出发点无非是想进一步规范我国的药品生产各环节,以使我国的药品质量有保证。但是这客观上势必造成药企经营、财务负担的加重,尤其在医药行业整体下行的环境下。但是没办法,改革必然有痛苦,而这个痛苦是所有产业链上的节点都不能逃避的。可谓暴风所到之处,地上一片狼藉。
此是后话,咱们现在单说这个生产工艺核对的事。
其一,生产工艺与什么核对?如同仿制药有参比制剂一样,凡事都有参照。这里的生产工艺核对的参照物是药企在向CFDA生产报批时所申报的工艺,即核对药企在实际生产中使用的工艺与原来的申报工艺是否一致。那有看官就问了,这个…难道不是“天然”应该一致吗? too young too simple, sometimes naive. 实际上,药企的申报工艺和生产工艺不一致是相当普遍的现象。有三个主要原因:1.主观方面。有些药企为了避免核心生产工艺“霸气外露”,在申报的时候会有意隐藏一些关键参数,从而导致不一致;2.客观方面。这是研发和生产脱节的表现,比如研发团队在申报的时候是在小试中试的情况下的工艺,可是在实际大生产中这些工艺不奏效。怎么办?只能改,从而导致不一致。3. 对于中药的制备,本身随意性就比较大,所以出现不一致貌似是非常“正常”的事情。
其二,这个生产工艺核对与仿制药一致性评价有何关联?我们知道,一致性评价针对的是基本药物目录中的289种化药口服固体制剂,而生产工艺核对针对的不只是化药,还有中药,生物药,所以首先这个范围是不同的。由于中药在制备上的“灵活性”,所以有专家认为中药领域很可能是此次生产工艺核对的“重灾区”,买中药股需谨慎啊。其次,在剂型方面。由于2007年CFDA已经就注射剂(含中药注射剂)进行过生产工艺核查工作,因此可以认为本轮核对工作不会波及注射剂药品。 再次,一致性评价针对的是2007年10月1日前上市的化药,本身这些药比较老。而生产工艺核对所针对的药品不限“年龄”,年轻药也有份儿。但是,一般来说,较新的药品相对地生产工艺和申报工艺不一致的情况比老药少,因此,我们可以认为在老药方面生产工艺核对与仿制药一致性评价有很大的交集。
其三,如果被查到生产工艺和申报工艺不一致后果是不是很严重?答案:还是有点狠的。不过政策的出发点并非是惩罚而是鼓励提升质量,所以认真执行CFDA文件精神并积极配合的话过关应该问题不大。CFDA也给出了时间线,如下:
2016/10/1前,药企对自己产品生产工艺开展自查并上报省局。在之后的评估中,若两个工艺一致,则万事大吉;若是不一致,且经研究验证发现,改变后的生产工艺对药品质量产生影响的,则药企立即停止生产该药品。直到其向省局提交的补充申请经CFDA药审中心技术审评通过后方可恢复生产。
2016/11/1前,各省局汇总申报信息并上报总局,之后总局组织展开飞行检查。如果在飞行检查中“发现实际生产工艺与食品药品监管部门批准的生产工艺不一致的,依据有关规定,其所生产的药品按假药论处。药监部门将依据有关规定对涉事药品生产企业进行处罚,并向社会公开相关企业法定代表人和相关责任人员”。唉呀妈呀,吓死宝宝了!所以大家伙儿还是打起精神认真对待吧,别存侥幸心理,查住了可不是闹着玩儿的。
2017/06/30是此次核对工作的大限,药企应完成在产品种生产工艺的研究验证、提交补充申请等相关工作,其他暂不生产品种应于2017年12月31日前完成上述工作;未按时完成的,应停止生产。
总的来看,药品生产工艺核对工作是监管部门对药品质量把关趋严的举措,是之前临床核查,一致性评价政策的延续。这也彰显了监管部门对于提升药品质量和安全性的决心。这一系列的政策肯定会驱动并加速质量低下药品的消亡,促进医药行业的洗牌和集中度的提升。对药企而言,短期“紧箍咒”痛苦在所难免,尤其是对那些还在进行着紧张的一致性评价的药企,两线作战并不好受。但是仔细考察过这个生产工艺核对及其时间线会发现,实质上其与一致性评价并不冲突。对于一致性评价的药企来说,其本身也面临着待评价药品的生产工艺的评估和变更工作,从这方面来说,其可以将生产工艺核对工作纳入到一致性评价的工作框架中来,这样会省时省力很多。
附 总局办公厅公开征求《关于开展药品生产工艺核对工作的公告(征求意见稿)》的意见
为进一步规范药品生产工艺管理,保障公众用药安全,食品药品监管总局组织起草了《关于开展药品生产工艺核对工作的公告(征求意见稿)》,现向社会公开征求意见。请将修改意见于2016年9月10日前通过电子邮件反馈至食品药品监管总局药品化妆品注册管理司。
联系人:薛彦久
电子邮箱:yhzcszhc@cfda.gov.cn
关于开展药品生产工艺核对工作的公告
(征求意见稿)
药品生产工艺是持续稳定地生产出合格药品的过程和方法,按照监管部门批准的生产工艺组织生产是保障药品质量的前提。为加强药品生产工艺管理,原国家食品药品监督管理局于2007年8月部署开展了注射剂类药品生产工艺和处方核查工作,各省局对企业申报登记的生产工艺等相关资料进行了审查,初步建立了注射剂生产工艺等资料档案。2007年10月修订实施的《药品注册管理办法》规定批准药品上市前应进行生产现场检查,保障了技术审评部门核定的生产工艺的可行性,此后批准上市的绝大多数药品的实际生产工艺与批准的生产工艺是一致的。近年来,食品药品监管部门在监督检查中发现仍有部分2007年前批准上市的品种未按照批准的生产工艺组织生产、改变生产工艺不按规定研究和申报。为此,总局决定开展药品生产工艺核对工作。现就有关事项公告如下:
一、药品生产企业承担药品质量安全的主体责任,必须严格按照食品药品监管部门批准的生产工艺组织生产。药品生产企业改变已批准的生产工艺,必须经过充分的研究和验证,并按照《药品注册管理办法》的有关规定提交药品注册补充申请。
二、自本公告发布之日起,药品生产企业应对每个批准上市药品的生产工艺(中药为制法,下同)开展自查,排除质量安全隐患。
三、自查内容为药品的实际生产工艺与报经食品药品监管部门批准的生产工艺是否一致。食品药品监管部门批准的生产工艺包括审批药品生产申请时批准的生产工艺及审批相关补充申请时批准的生产工艺。
四、药品生产企业应于2016年10月1日前完成自查并将自查情况报所在地省级食品药品监管部门。省级食品药品监管部门应对企业自查情况进行汇总,填写自查情况汇总表(附件1)并于2016年11月1日前上报食品药品监管总局。
五、药品生产企业根据自查结果,应分别采取以下处理措施:
(一)实际生产工艺与批准生产工艺一致、能够保证药品质量的,药品生产企业应将自查情况报告与药品生产工艺等资料一并归档,作为监管部门开展日常监管、现场核查的备查资料。
(二)实际生产工艺与批准生产工艺不一致的,相关药品生产企业应按照《药品生产质量管理规范》《药品注册管理办法》补充申请事项的相关要求以及《已上市中药变更研究技术指导原则(一)》《已上市化学药品变更研究的技术指导原则(一)》《生物制品生产工艺过程变更管理技术指导原则》等相关技术要求开展充分的研究验证。
经研究验证,生产工艺变化对药品质量不产生影响的,药品生产企业应按照《药品注册管理办法》附件4第18项提出补充申请,申报资料要求见附件2。省级食品药品监管部门于受理后5日内将申报资料送交国家食品药品监督管理总局药品审评中心(以下简称“药审中心”)。药审中心依据《药品注册管理办法》开展技术审评,必要时可以要求申请人补充资料,所需时间不计入技术审评时限。国家食品药品监督管理总局依据《药品注册管理办法》作出审批决定。
经研究验证,生产工艺变化对药品质量产生影响的,企业应立即停产。药品生产企业应按照《药品注册管理办法》附件4第7项提出“改变影响药品质量的生产工艺”补充申请。省级食品药品监管部门于受理后5日内将申报资料送交药审中心。药审中心应组织专门审评力量、建立单独审评通道,于收到申报资料后30日内完成技术审评,必要时可以要求申请人补充资料,所需时间不计入技术审评时限。国家食品药品监督管理总局应在5日内完成行政审批。补充申请获批后,药品生产企业方可继续生产。
药品生产企业应于2017年6月30日前完成在产品种生产工艺的研究验证、提交补充申请等相关工作,其他暂不生产品种应于2017年12月31日前完成上述工作;未按时完成的,应停止生产。
六、2016年11月1日起,国家食品药品监督管理总局将组织专家对药品生产企业开展飞行检查。检查中发现实际生产工艺与食品药品监管部门批准的生产工艺不一致的,依据《中华人民共和国药品管理法》第四十八条第二款的有关规定,其所生产的药品按假药论处。药监部门将依据《中华人民共和国药品管理法》第七十四条的有关规定对涉事药品生产企业进行处罚,并向社会公开相关企业法定代表人和相关责任人员。
七、发生过影响药品质量的生产工艺变更,但生产企业能够确保产品安全有效的,符合下列情形的,可以暂不停产,但需要按本公告要求提出相关补充申请。
(一)相关品种在《药品注册管理办法》2007年修订实施前已经发生影响药品质量的生产工艺变更,此后一直正常生产,生产工艺稳定且未发现安全性和有效性问题的;
(二)相关品种发生影响药品质量的生产工艺变更,变更后的生产工艺属于技术进步或创新的。
八、本公告自发布之日起实施,进口药品参照执行。
特此公告。
附件:1.药品生产工艺自查情况汇总表
2.申报资料要求(不影响药品质量的生产工艺变更)
3.药品生产工艺变更情况表
来源:雪球 作者:许三多333
为你推荐
 资讯
资讯 艾凯生物完成A3轮超亿元融资,加速AI驱动iPSC细胞治疗与类器官平台升级
本轮融资由知壹投资与沃杰资本联合领投,联新资本持续追加投资,资金将重点用于推进AI驱动的iPSC细胞治疗产品临床转化,加速完善iPSC细胞治疗与类器官两大核心技术平台布局。
2026-03-10 18:22
 资讯
资讯 中科搏锐斩获数千万B轮融资,推动脑机接口全产业链产业化落地
本轮融资由国内知名投资机构三泽创投独家投资,凯乘资本担任长期独家财务顾问,所筹资金将全力支撑公司深化脑机接口全产业链布局,加速尖端技术的临床转化与产业化落地。
2026-03-10 18:03
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
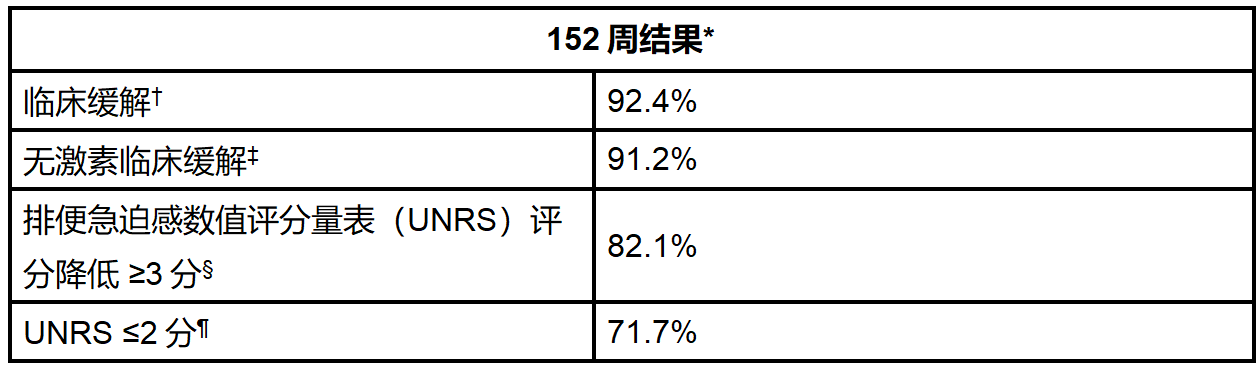
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22