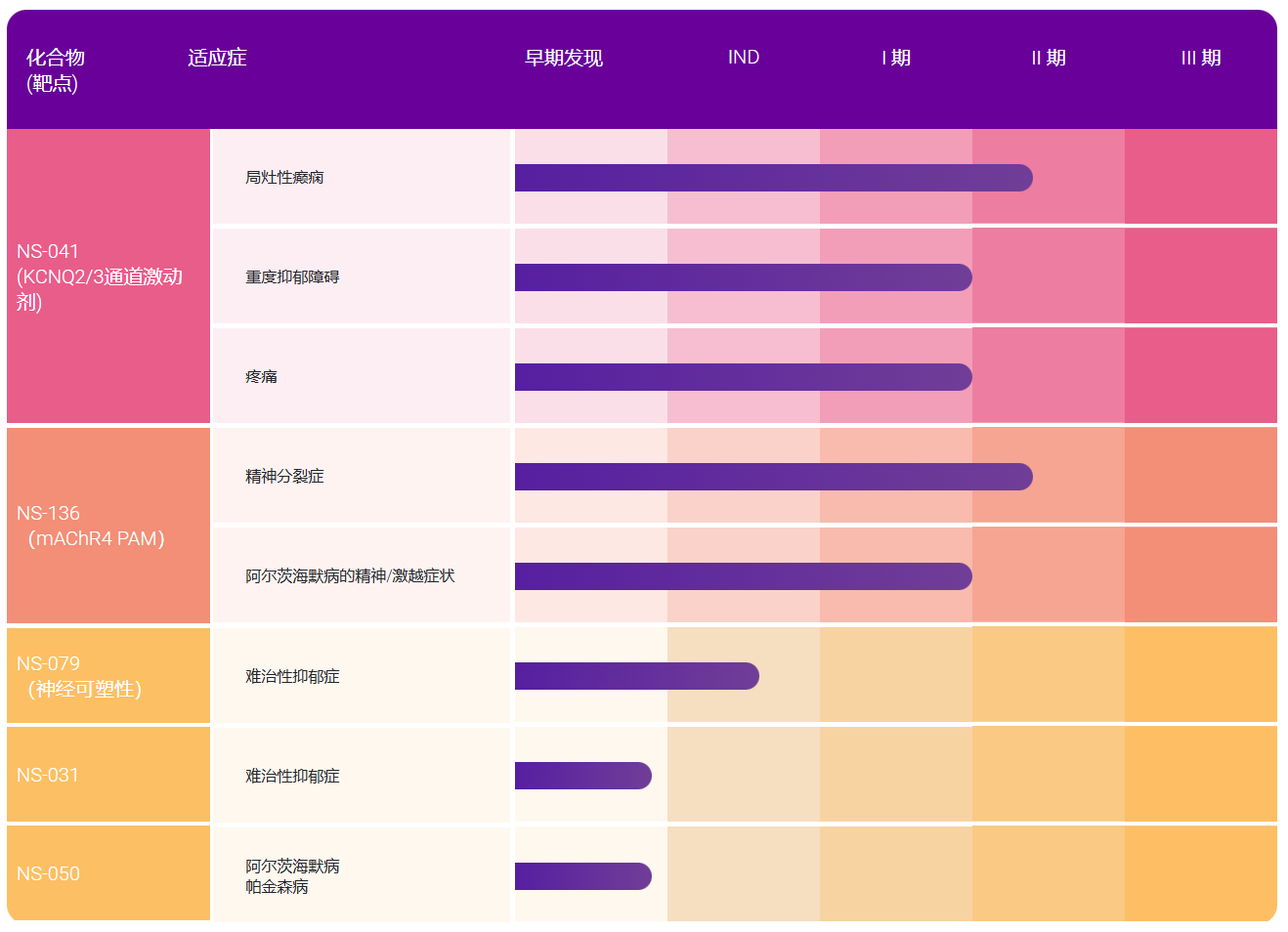
近日,美国国立卫生研究院宣布投入5500万美元用于精准医疗计划,并建立至少包含100万名志愿者的全国精准医疗研究,同时FDA公布了两份NGS体外诊断指南草案。
指南一:《基于NGS的遗传性疾病体外诊断指南》
第一份指南标题为《基于NGS的遗传性疾病体外诊断指南》,分为八部分,包括前言、背景、范围、遗传性疾病NGS检测的分类和上市前审查、遗传性疾病NGS检测涉及的要素、遗传性疾病NGS检测的设计、开发和验证指导建议、修正和其他资源。
范围
该指南将为遗传性疾病的NGS检测提供设计、开发及验证指导建议;测试开发人员可遵循该指南为检测方案的上市做准备;该指南中的建议适用于遗传性疾病的检测,无论结果直接面向患者还是医务人员均可适用,但当检测结果直接面向消费者时,需增加额外的建议和管理。
该指南不适用于仅以诊断为目的的NGS检测,也不适用于以筛查、微生物基因检测、风险预测、细胞游离DNA检测、胎儿检测、胚胎植入前遗传检测、肿瘤基因组检测、RNA测序或伴随诊断为目的的检测,因为这些检测具有该指南未包含的其他特征。
遗传性疾病NGS检测的分类和上市前审查
迄今为止,FDA已了解了部分单基因疾病、疾病特异性、靶向检测及NGS检测等。然而,FDA未曾对遗传性疾病NGS检测进行分类,因此该类检测在法律中被自动归为III类,目前还未有合法的市场管理来审查NGS检测上市前的通知。因此,该指南草案考虑将基于NGS的遗传病检测归为II类检测以及免除上市前通知的要求。从长远来看,FDA考虑如何将这些指导建议制成标准规范,以及能否通过FDA的特殊管理来豁免上市前通知的规定。根据该指南,目前这类检测必须获得FDA批准后才能上市。
遗传性疾病NGS检测涉及的要素
基于NGS的临床检测通常涉及到试剂、耗材、仪器和软件。不同的检测目标对应着不同的试剂、耗材、仪器和软件,因此不同的NGS检测有不同的设计方案和工作流程。
遗传性疾病NGS检测的设计、开发和验证指导建议
指南指出,开发人员首先应该确定检测的适应症,因为这决定了检测的方向;在确定适当的检测性能时,开发人员应该前瞻性地确定研究类型以及阈值。在检测的设计和开发完成之后,应进行试验验证是否达到预定义的效果。若验证结果中有一项未达到要求,则必须对试验进行修改并重新验证,直到验证结果达到预定义的性能为止,设计、开发和验证是一个周期,应时刻保持完整。在此过程中,开发人员应该记录所有的检测行动、决定和结果,以及执行这些检测的理由。
修正
重新评估检测性能之前总要先进行试验修正,FDA对试验修正提出了以下几点建议:
应准备好与试验修正有关的所有文档,包括协议,例如软件更新和其他生物信息学渠道的修正;
在修正试验之前,应该先准备好能生效的详细SOP,SOP文件应表明预期的修改方案以及修改试验相关的补充程序,包括后续使用的验证研究类型、必须达到的性能指标和阈值;
利用足够量的特征样本进行二次验证,记录样本的数量和类型,并说明选择这些样本的理由;
记录修正后使用的验证研究类型,并记录修正后的测试性能;
恰当时期重新生效整个检测方案;随着时间的推移,若需进行多重修正,应分别评估每一次修正以及多次修正整合后的结果;
若在现有panel中添加新的基因,应对panel上的原始基因进行评估检测和文档记录。若修正后的测试未达到要求,则要重新设计检测方案;
应准备一个程序来解释内部和外部数据库的更新以及这些更新对临床变体解释的影响。记录每一次更新,包括名称、位置和新版本的数据库。
指南二:《使用公共人类遗传差异数据库来支持基于NGS的体外诊断的临床有效性》
第二份指南为《使用公共人类遗传差异数据库来支持NGS体外诊断的临床有效性》,该指南分为五部分,包括前言、背景、范围、建议将人类遗传变异数据库中的公开数据作为NGS检测临床有效性的科学证据、FDA基因变异数据库的识别过程。
该指南中所讨论的遗传变异数据库只包括人类遗传变异,不包含用于微生物基因组鉴定、抗菌素耐药性检测以及标记毒性的数据库,本指南对分类和解释遗传变异的软件也不适用。
该指南建议测试研发人员使用可公开访问的遗传数据库中的信息来验证检测方案能否准确预测疾病,而不仅仅局限于各个单位的独立数据。FDA希望以此来加速基于NGS的体外诊断进入市场的步伐。
原文检索
《使用公共人类遗传差异数据库来支持NGS体外诊断的临床有效性》
来源:生物探索
为你推荐
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
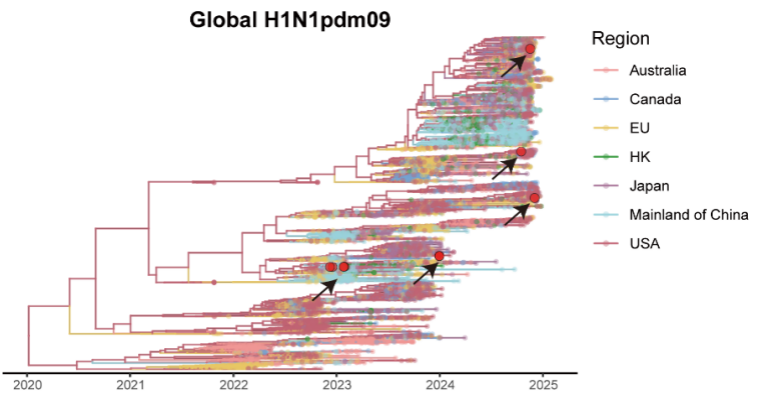
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22
 资讯
资讯 箕星药业宣布成功完成D1轮2.87亿美元融资,推进口服GLP-1药物开发
1月22日消息,箕星药业有限公司(Corxel Pharmaceuticals Limited)宣布已成功完成D1轮融资,募集资金高达2 87亿美元。
2026-01-23 18:00