2019年6月,欧美和中国药品上市获批数量较上月均有所减少。国产医疗器械的注册审评格局趋势良好,相比进口器械优势明显。
一、全球药品获批情况
2019年6月药品审评数据发布,美国批准新药中约1/3为孤儿药,热度不减。另本月新批准2个生物类似药。2019年6月欧盟和中国获批药品数量较上月下降明显。
(一)美国FDA批准情况
自2019年以来,美国受理批准总数达602个,陆续已有50款NDA/BLA药品获批(不包含暂批药物)。 从2019年上半年获批数量看,本年NDA/BLA药品批准情况可能不及往年。见图1。
图1 2010—2019年FDA药物批准数量变化情况
2019年6月,FDA共完成53项药品首次批准(不包含临时批准),其中NDA/BLA批准8个(不包含暂批药物),相对上月(批准总数74件,NDA/BLA 7件)批准数量有所减少, 其中1个新分子实体药物被批准,有2种药物属孤儿药:
表1 2019年6月FDA批准NDA/BLA列表
本月FDA批准NDA/BLA中,有4款药品值得关注,具体情况如下:
(1)6月10日,基因泰克的抗体偶联药物Polivy(polatuzumab vedotin-piiq)获FDA批准上市,与苯达莫司汀与rituximab联合使用,治疗难治的弥漫性大B细胞淋巴瘤成人患者。这是一款抗体偶联药物(ADC)。Polivy的临床表现优异,其治疗组的患者完全缓解率(40%)高过标准治疗组(18%)一倍有余。先前它还获得美国FDA授予的突破性疗法认定、优先审评资格、以及孤儿药资格。
(2)6月13日,安进/艾尔建的曲妥珠单抗生物类似药(Biosimilar)Kanjinti(trastuzumab-anns,赫赛汀)获FDA批准上市,用于治疗HER2过度表达的乳腺癌和胃癌或胃食管连接部癌。截至目前,欧盟和FDA共批准了5款曲妥珠单抗类似药,其中欧洲市场已经有曲妥珠单抗生物类似药上市销售,但美国市场由于专利纠纷尚未解决,未见该生物类似药销售。
(3)6月21日,Palatin制药公司的Vyleesi(bremelanotide注射液,布美诺肽)获FDA批准,用于治疗绝经前女性的获得性、广义的机能减退型性欲障碍(HSDD)。Vyleesi较之FDA批准的首个HSDD药物Addyi优势明显,做到了与男性伟哥一样按需随时服药,30min起效,疗效可持续8h,且不需要禁酒,不良反应仅有轻微恶心。因此之前就已获得普遍好评,AMAG公司预计上市后可能带来10亿美元的销售额,2017年从该药的研制公司Palatin Technologies 公司获得了在美国的商业化权力。
2017年9月,复星医药以1.05亿美元获得该产品在大中华区(包括大陆、台湾、香港、澳门)的独家商业化和非独家开发、制造权利。2019年4月,Vyleesi治疗HSDD已获中国国家药品监督管理局临床试验注册审评受理。
(4)6月28日,辉瑞(Pfizer)的Zirabev(bevacizumab-bvzr,贝伐单抗)获FDA批准,该药是罗氏Avastin的生物类似药,用于治疗5种类型的癌症:转移性结直肠癌,不可切除性、局部晚期、复发或转移性非鳞状非小细胞肺癌(NSCLC),复发性胶质母细胞瘤,转移性肾细胞癌(RCC),持续性复发性或转移性宫颈癌。贝伐单抗Avastin(安维汀,通用名:bevacizumab)是罗氏旗下仅次于赫赛汀(Herceptin,69.92亿瑞士法郎)的第二大畅销药,2018年全球销售额为68.49亿瑞士法郎。至此,辉瑞(包括其2015年收购的Hospira)已在FDA成功获批5项生物类似药,高踞榜首。
图2 截至2019年6月30日制药企业生物类似药FDA批准情况
表2 2019年6月FDA批准的13项药物的新适应证列表
上表中FDA批准生物类似药品中,有7款药品值得关注,具体情况如下:
(1)6月3日,默沙东复方抗生素产品Zerbaxa获FDA批准,用于治疗18岁及以上成人患者由某些易感革兰氏阴性菌引起的医院获得性细菌性肺炎(HABP)和呼吸机相关细菌性肺炎(VABP)。HABP和VABP目前是美国第二常见的医院感染类型,是发生在重症监护病房(ICU)患者中的一个重要问题,可导致严重感染甚至死亡。此前FDA已授予Zerbaxa治疗HABP/VABP的合格传染病产品(QIDP)资格(额外5年的市场独占权)以及优先审查资格。
(2)6月4日,礼来的Emgality获FDA批准,用于治疗丛集性头痛,这是Emgality继预防丛集性头痛之后获批的第二个适应证,也使其成为首款获批用于治疗丛集性头痛的药物。此前Emgality曾获FDA优先审查资格。
(3)6月11日和17日,FDA分别批准了默沙东的Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗)的两项新适应证,用于转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线治疗,以及单药治疗转移性小细胞肺癌(加速批准)。至此Keytruda已在美国获批20个适应证。
(4)6月20日,艾尔建的Botox获FDA批准新增适应证,用于治疗2岁及以上儿科患者上肢和下肢痉挛。该申请此前被授予6个月优先审查,Botox也由此成为治疗儿童上下肢痉挛的首个神经毒素疗法。
(5)6月27日,强生的Darzalex被FDA批准联合来那度胺和地塞米松治疗多发性骨髓瘤,Darzalex是一种人免疫球蛋白G1kCD38单克隆抗体,可通过免疫调节作用直接和间接地靶向多发性骨髓瘤细胞表面高表达的CD38分子,诱导肿瘤细胞凋亡。Darzalex曾在2015年作为市场上第一个Anti-CD38的单克隆抗体,被FDA授予突破性疗法资格快速获批。
(7)6月28日,Alexion公司的畅销药Soliris获FDA批准第四个罕见病适应证,用于治疗视神经脊髓炎谱系障碍(NMOSD),此批准获得FDA优先审评资格和孤儿药资格。Soliris是全球最昂贵的药品之一,定价高达50万美元/年,该药也是全球最畅销的孤儿药之一,据医药咨询公司Igeahub统计其位居《2018年最畅销孤儿药TOP10》榜单第4位。
(二)欧盟EMA批准情况
截至2019年7月4日,EMA在2019年批准上市药品共计26个,其中新活性物质(New active substance,NAS)15个,2010年至今的批准情况见图3。2019年6月批准药品2个,见表3。
图3 EMA历年批准药物情况
表3 2019年6月EMA批准的药物列表
本月EMA批准药物的具体情况如下:
(1)6月20日,由Titan制药和Braeburn制药联合研发的植入性阿片成瘾药物Sixmo获EMA批准上市,其是一种皮下植入性的丁丙诺啡,一次植入能够为患者释放长达六个月的低剂量丁丙诺啡,可在长期稳定给药的同时避免新的药物成瘾。此前在2016年12日就已作为首个植入性阿片成瘾药物被FDA批准在美国上市。
(2)6月20日,诺和诺德长效凝血因子VIII产品Esperoct(N8-GP)获EMA批准,该产品用于A型血友病成人及儿童患者,用于常规预防以按需治疗和控制出血发作、围手术期出血管理、减少出血发作频率。
Esperoct(N8-GP)是一种应用糖基聚乙二醇化技术的重组凝血因子VIII产品NovoEight(turoctocog alpha),该技术能够延长重组凝血因子VIII的循环半衰期,从而减少静脉给药次数,并降低出血发作频率。与标准半衰期因子VIII产品相比,Esperoct在成人/青少年患者中的半衰期延长1.6倍,在儿童患者中的半衰期延长1.9倍。2019年2月21日,Esperoct就获得美国FDA的上市批准,但受第三方知识产权协议限制会延迟至2020年之后在美国上市,诺和诺德表示此次获EMA批准后,希望在2019年下半年即在欧盟获批范围内率先上市。
(三)NMPA批准情况
截至2019年7月4日,2019年6月NMPA共批准药品首次上市15件,均为国产药品。除去剂型后,共9个品种,仅安徽安科的“重组人生长激素注射液”为生物制品,其他均为化药。本月药品批准数量较上月有明显下降。从获批企业分布看,仅正大天晴获得2种药品批准,分别为钆塞酸二钠注射液和盐酸莫西沙星氯化钠注射液。
2019年6月获批药品中,通过CDE优先审评程序获批2个,其中正大天晴的钆塞酸二钠注射液为国内首仿。见表4。
表4 2019年6月NMPA批准的新药列表
二、全球医疗器械获批情况
根据2019年6月医疗器械审评数据,提示6月份国内注册审评格局趋势良好,相比进口器械有明显优势。国内自主研发的2个医疗器械获得创新医疗器械资格认定并进入特别审批通道。
(一)美国FDA批准情况
根据数据统计,2019年6月,FDA共批准226个产品,其中通过上市前通知510(k)途径上市223 个,包括一类器械11个,二类器械211个,未分类1个;通过上市前批准(PMA)途径上市的医疗器械产品3个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,矫形外科和心血管类产品获批上市最多,与上月保持一致,见图4。
图4 2019年6月通过FDA 510(k)途径获批上市产品类型分布情况
(二)境内批准情况
1. 医疗器械进入特别审批程序和优先审批程序情况
2019年6月,共有2个国产医疗器械获得创新医疗器械资格认定并进入特别审批程序,同期有3个医疗器械被纳入医疗器械优先审批程序,见表6和表7。
表6 2019年6月NMPA公示创新医疗器械资格
表7 2019年6月NMPA公示医疗器械优先审评资格
2. 国家局批准首次注册医疗器械产品情况
2019年6月,国家局共批准首次注册医疗器械产品 146个,其中境内第三类(含体外诊断试剂)医疗器械产品 24个;进口医疗器械产品122 个,包括一类99 个、二类 19 个和三类4个。
截至2019年7月4日,各省级药品监管部门共批准境内第二类医疗器械注册404个,一类备案医疗器械423个,提示国内医疗器械的发展潜力良好。
统计数据显示,体外诊断试剂数量最多,共427项,占44%,其中国产最多,有401项,占94%。该类别绝大部分是试剂盒、质控品和校准品等体外诊断分析试剂。除体外诊断试剂外,批准注册类别排前三位的分别为注输、护理和防护器械、口腔科器械及物理治疗器械。
表8 2019年6月境内、进口医疗器械批准注册类别数目分布情况
从地域分布上,境内注册产品生产企业主要集中在广东、浙江、北京和上海,其医疗器械注册数量也较多。见图5。
图5 境内获批器械区域分布
来源:火石创造
为你推荐
 资讯
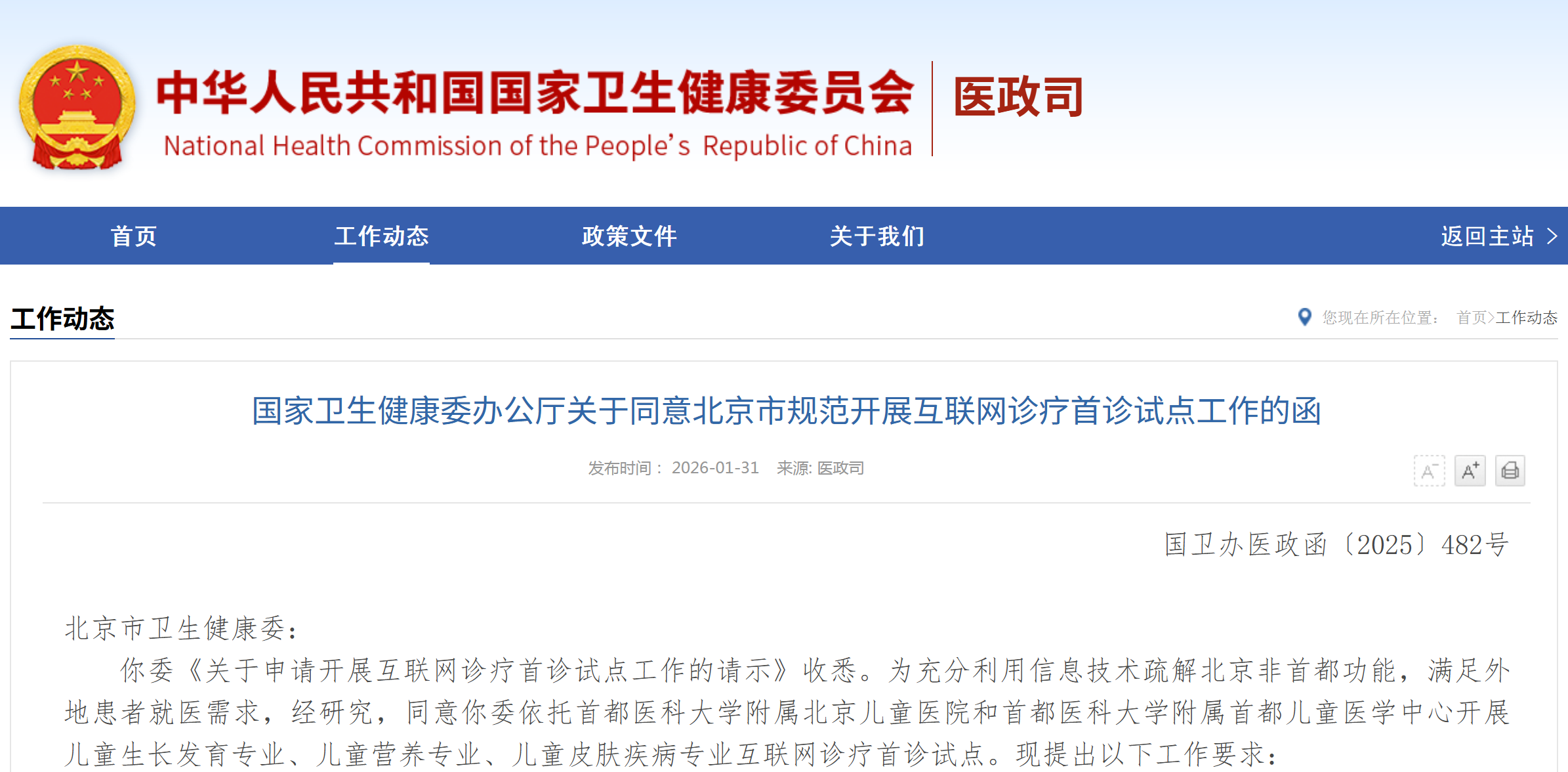
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
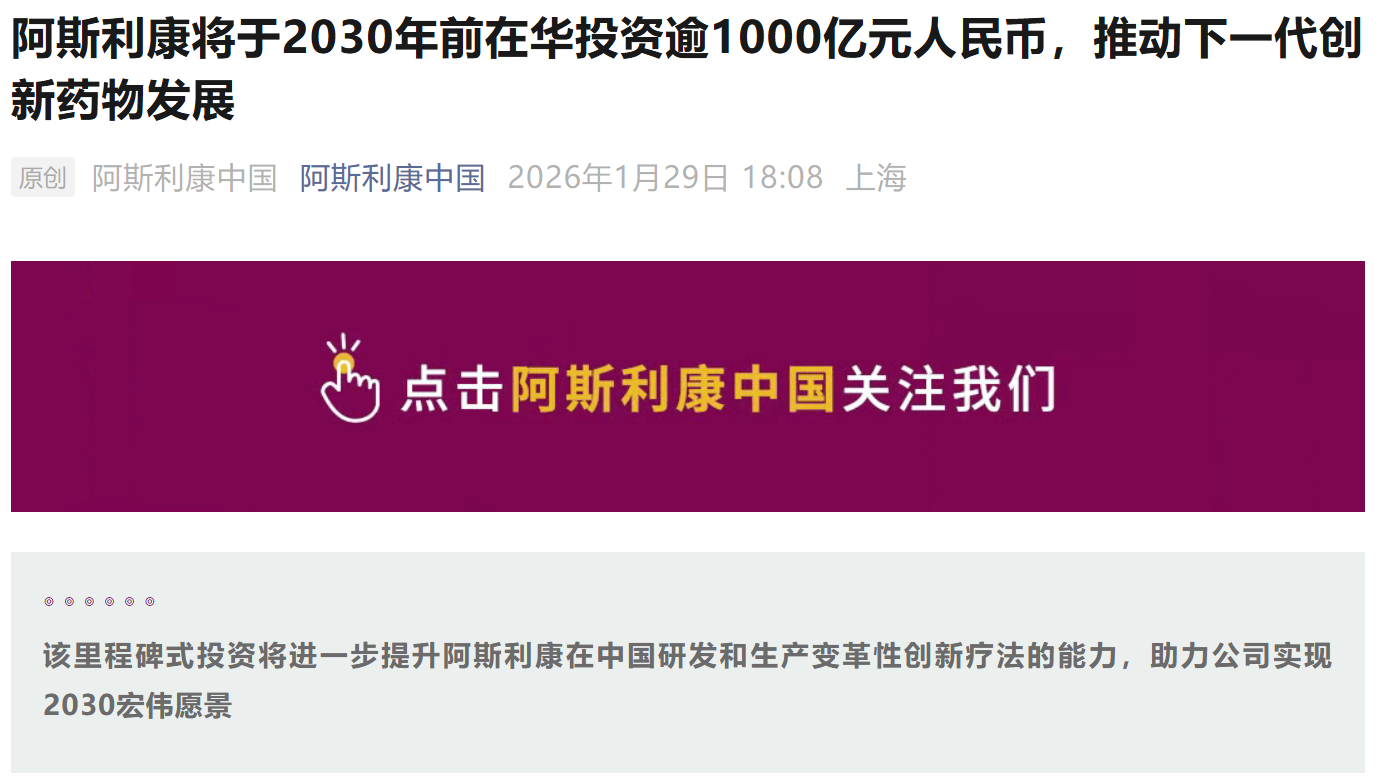
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
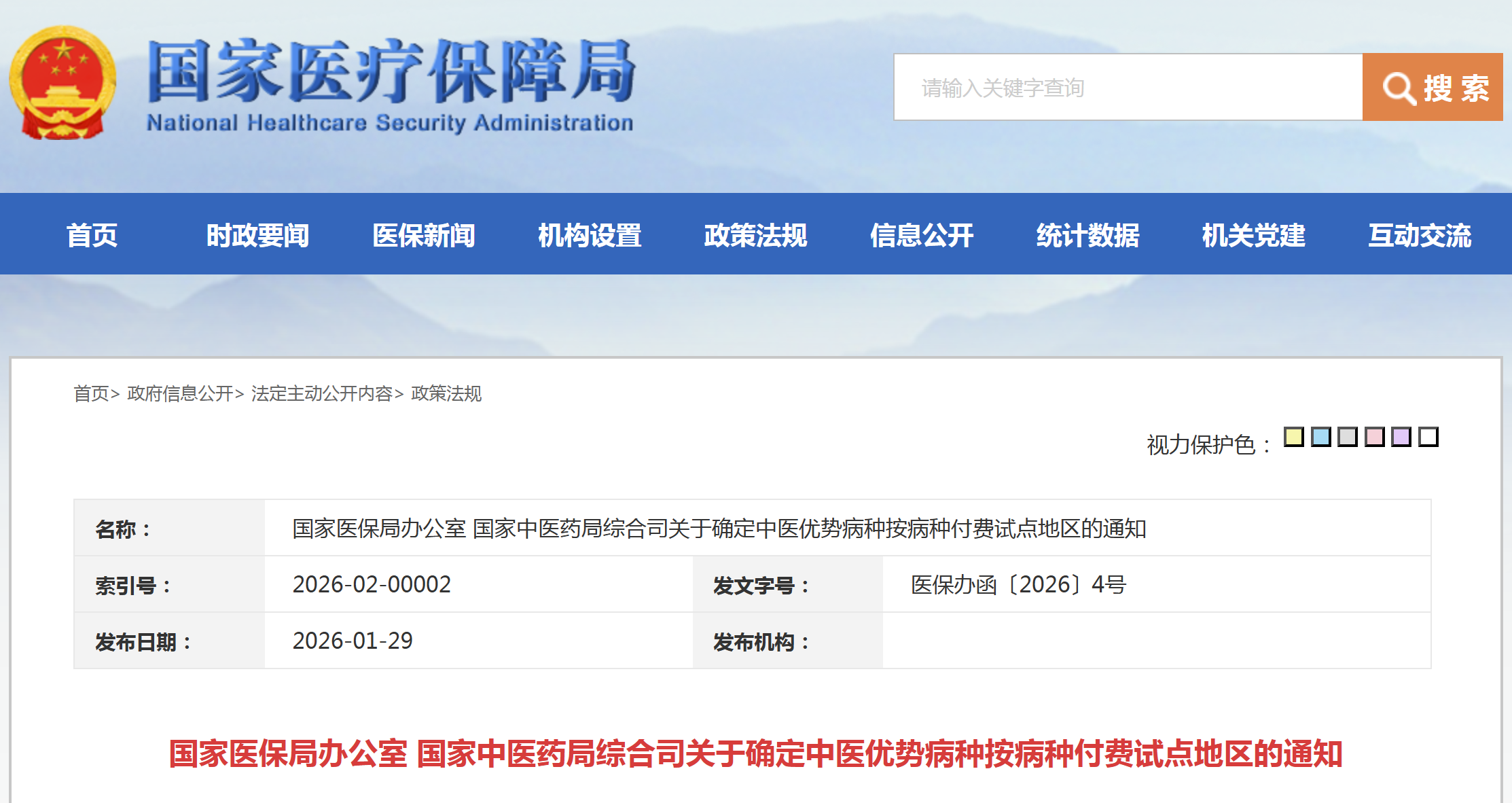
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
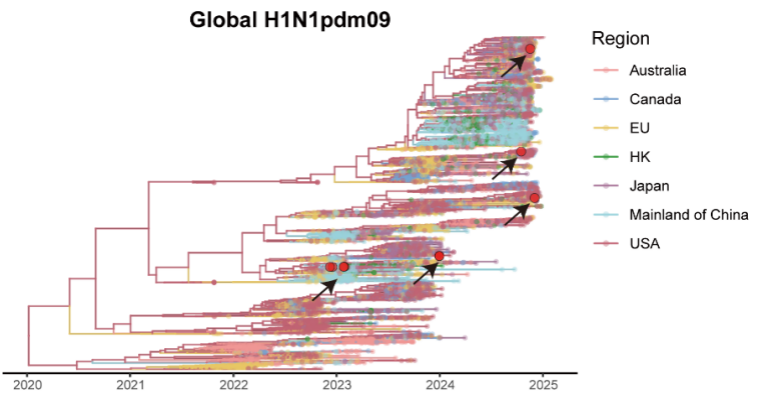 资讯
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22