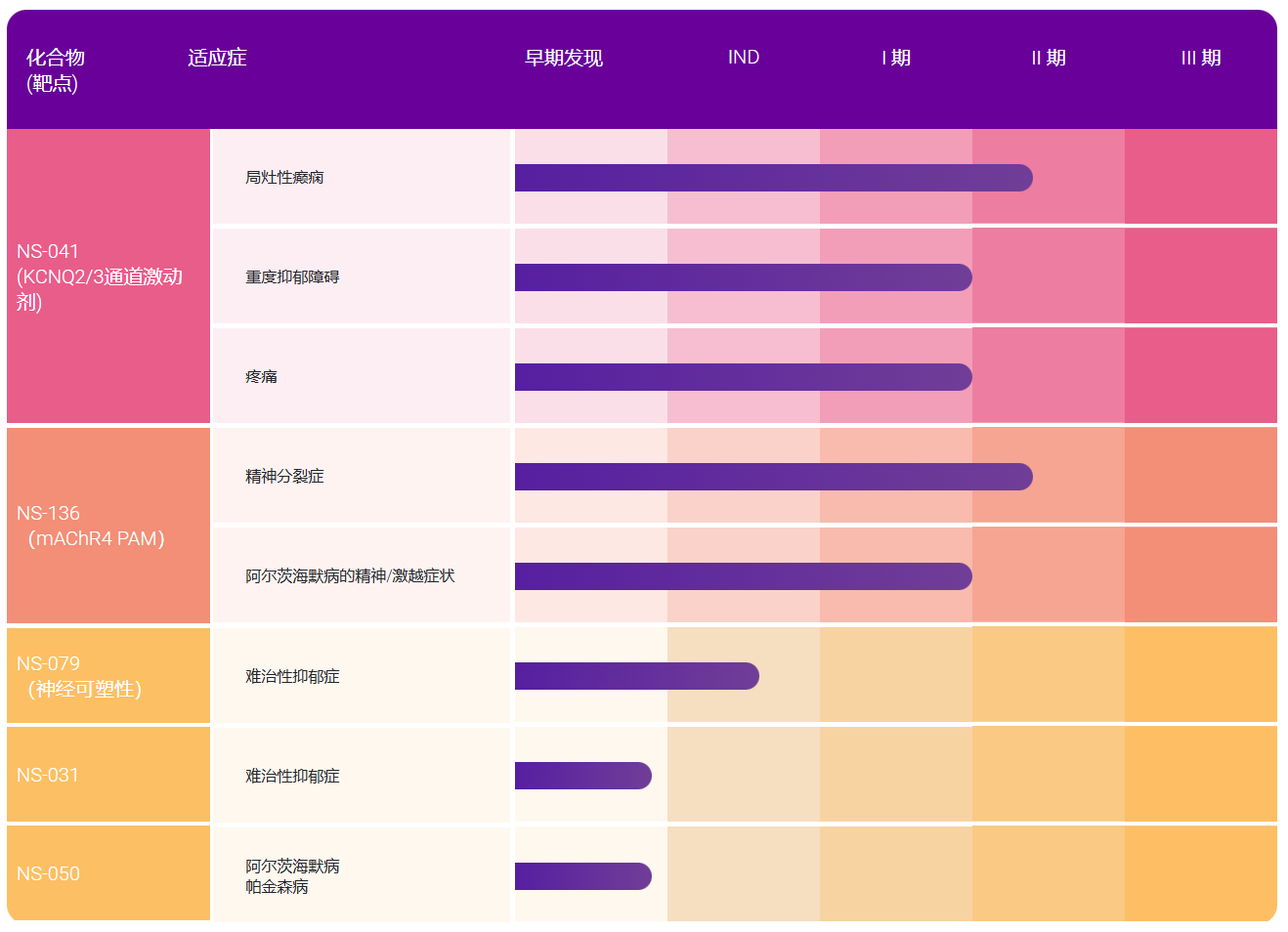
RedHill将受益于各项激励措施,大力开发胆管癌药物YELIVA?(ABC294640);同时如果该药物获得批准上市,还将获得七年时间的排他性销售权利;
晚期、不可切除、肝内和肝外胆管癌患者中的IIa期YELIVA?临床研究计划将于2017年第三季度启动;
胆管癌是一种高度致命的恶性肿瘤,患者迫切需要更有效的全身治疗手段和药物;根据肿瘤类型和诊断时间的不同,胆管癌患者的5年相对存活率在2%至30%之间;
在晚期实体瘤患者中进行的I期研究,YELIVA?成功达到了其主要和次要试验终点;一期研究对三名患者进行了试验,其中一例患者症状得到持续的部分缓解,另外两例患者病情则保持了稳定;
RedHill正在对YELIVA?进行几项I / II期临床研究,试验主要针对多种肿瘤学和炎症指征。其中的几项试验获得了国家癌症研究所(NCI)、Apogee生物技术公司和美国大学等的资助;
YELIVA是一种专有的、首创的口服鞘氨醇激酶-2(SK2)选择性抑制剂,具有抗癌和抗炎活性的特点;
RedHill Biopharma有限公司是一家专注于晚期临床阶段、专有口服胃肠炎等炎性疾病和癌症小分子药物的开发和销售的公司。该公司于2017年4月4日宣布,美国食品和药物管理局(FDA)已经批准了胆管癌药物YELIVA?(ABC294640)的罕见病药物申请。
获批罕见病药物后,RedHill将获得各种发展激励措施的帮助,包括合格临床测试的税收抵免、减免处方药用户费用(PDUFA费用)等,同时如果该药物获得批准上市,还将获得七年时间的排他性销售权利。
YELIVA?是一种专有的、首创的口服鞘氨醇激酶-2(SK2)选择性抑制剂,具有抗肿瘤和抗炎活性,可以靶向作用于多种肿瘤、炎症和胃肠道等适应症。通过抑制SK2酶,YELIVA?可以阻止丝氨酸1-磷酸(S1P)的合成,这样一来,丝氨酸1-磷酸促进癌症生长和病理性炎症的作用就被阻止。
RedHill肿瘤医学主任Mark L. Levitt博士说:“胆管癌是一种预后极度不良的癌症。目前可供这类患者选择的治疗方案很少,而且疗效也十分有限。基于有希望的临床前资料,以及三位之前接受过治疗的肝外胆管癌患者,YELIVA?进行了I期研究,我们希望YELIVA?能够为患者提供急需的新治疗方案。我们非常高兴该药物的罕见病药物申请获得了批准,目前我们正积极地IIa期研究的准备工作,目的是评估YELIVA?在不可切除、肝内和肝外胆管癌患者的安全性和有效性,试验计划在今年第三季度正式启动。”
胆管癌(胆管癌)是一种高度致命的恶性肿瘤,患者迫切地需要更有效的全身治疗手段。美国每年大约有8000人被诊断患有肝内或肝外胆管癌。最近的研究显示,胆管癌的发病率还在进一步增加,这主要是由于近期该疾病诊断技术的进展使得原本不能被诊断出来的的患者筛查了出来。目前,完全切除手术仍然是胆管癌的唯一治疗方法,但只有少数患者的肿瘤可以用此方法治疗。其他治疗方案包括放射治疗和化学治疗;然而,这些治疗方式的疗效也是十分有限的。尽管诊断和治疗胆管癌患者的能力总体上有所改善,但初次化疗失败的复发患者预后仍然很差,总体中位生存期约为1年。根据肿瘤类型和诊断时间的不同,胆管癌患者的5年相对存活率在2%至30%之间。
YELIVA?在南卡罗来纳医科大学(MUSC)Hollings癌症中心对晚期实体瘤患者进行了I期研究,该研究的最终结果满足了其主要和次要终点,证明了该药物耐受性良好,并且可以达到治疗效果的剂量安全地施用于癌症患者。
在I期研究中的3例胆管癌患者在之前均接受过了治疗,使用了YELIVA?后1例受试者获得了持续的部分缓解(总体生存= 20.3个月),其余2例患者延长了稳定期(总体生存分别为17.6个月和16.3个月)。
RedHill计划在2017年第三季度启动II期单臂临床研究,该研究将在晚期、不可切除的肝内、肝外胆管癌患者中进行。该研究将使用YELIVA?作为治疗胆管癌患者的单一药物,以确定胆管癌对这种治疗的疗效。
YELIVA?用于治疗晚期肝细胞癌(HCC)的II期研究正在南卡罗来纳医科大学Hollings癌症中心进行。该研究获得了NCI的180万美元资助,用于研究鞘脂代谢治疗各种实体性肿瘤的可行性,此外还得到了RedHill更多的支持。
杜克大学医学中心正在进行一项关于YELIVA?治疗难治性或复发性多发性骨髓瘤的Ib / II期研究。该研究Apogee生物技术公司(Apogee)与Duke大学合作进行,获得了由NEC小企业创新研究计划(SBIR)200万美元的资助,此外还得到了RedHill的额外支持
路易斯安那州立大学健康科学中心正在进行一项YELIVA?的I / II期临床研究,以评估该药物对难治性/复发性弥漫性大B细胞淋巴瘤以及卡波西肉瘤患者的疗效。这项研究同样得到了RedHill的额外支持和NCI的资助。
公司计划在2017年第三季度启动一项头颈癌患者黏膜炎的Ib期研究,以评估YELIVA?作为放疗患者预防粘膜炎的放射防护剂的效果;2017年下半年将启动中度至重度溃疡性结肠炎患者II期研究。
原文检索
来源:新浪医药新闻 作者:编译:范东东
为你推荐
 资讯
资讯 又一款老花眼滴眼液获批,市场有待检验
近日,Tenpoint Therapeutics宣布,美国FDA已批准Yuvezzi(carbachol和brimonidine tartrate滴眼液,2 75% 0 1%),用于治疗成人老花眼。
2026-02-02 14:06
 资讯
资讯 深度缓解数据惊艳:基于诺奖机制的 CELMoD药物如何重塑 MM 治疗逻辑?
近期,国家药品监督管理局药品审评中心(CDE)将CELMoD药物 iberdomide (以下简称:IBER)纳入优先审评名单并启动优先审评程序,拟批准
2026-02-02 13:22
 资讯
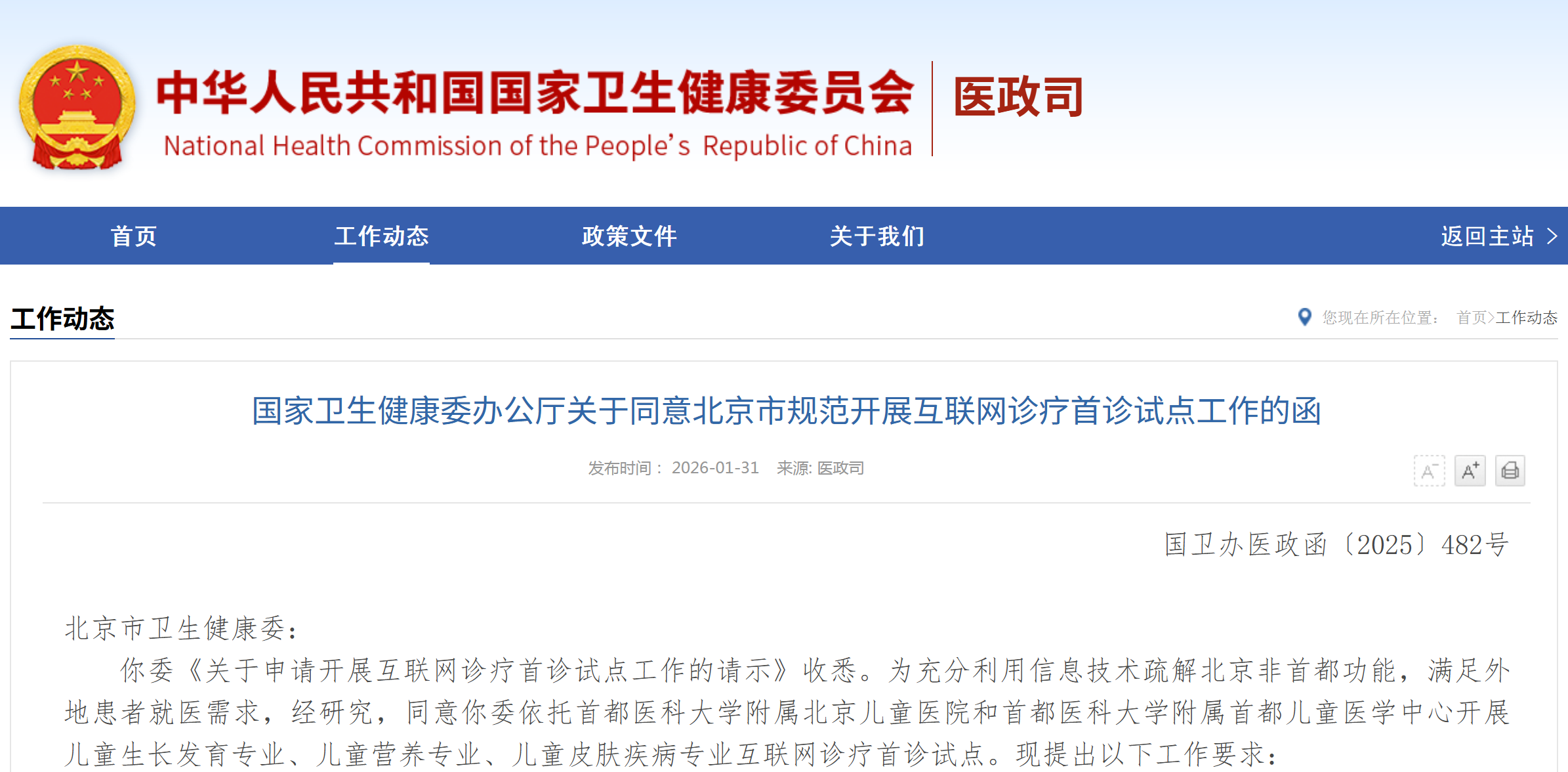
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
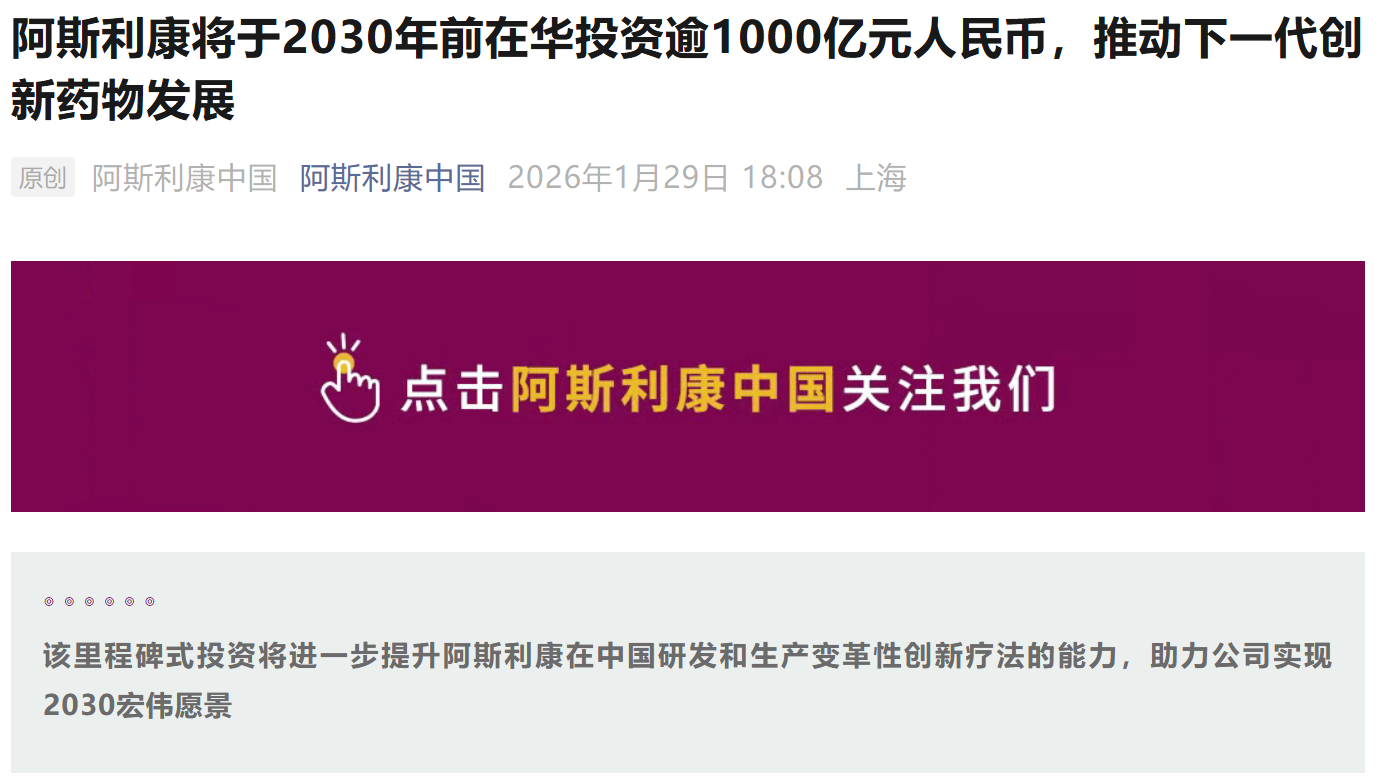
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
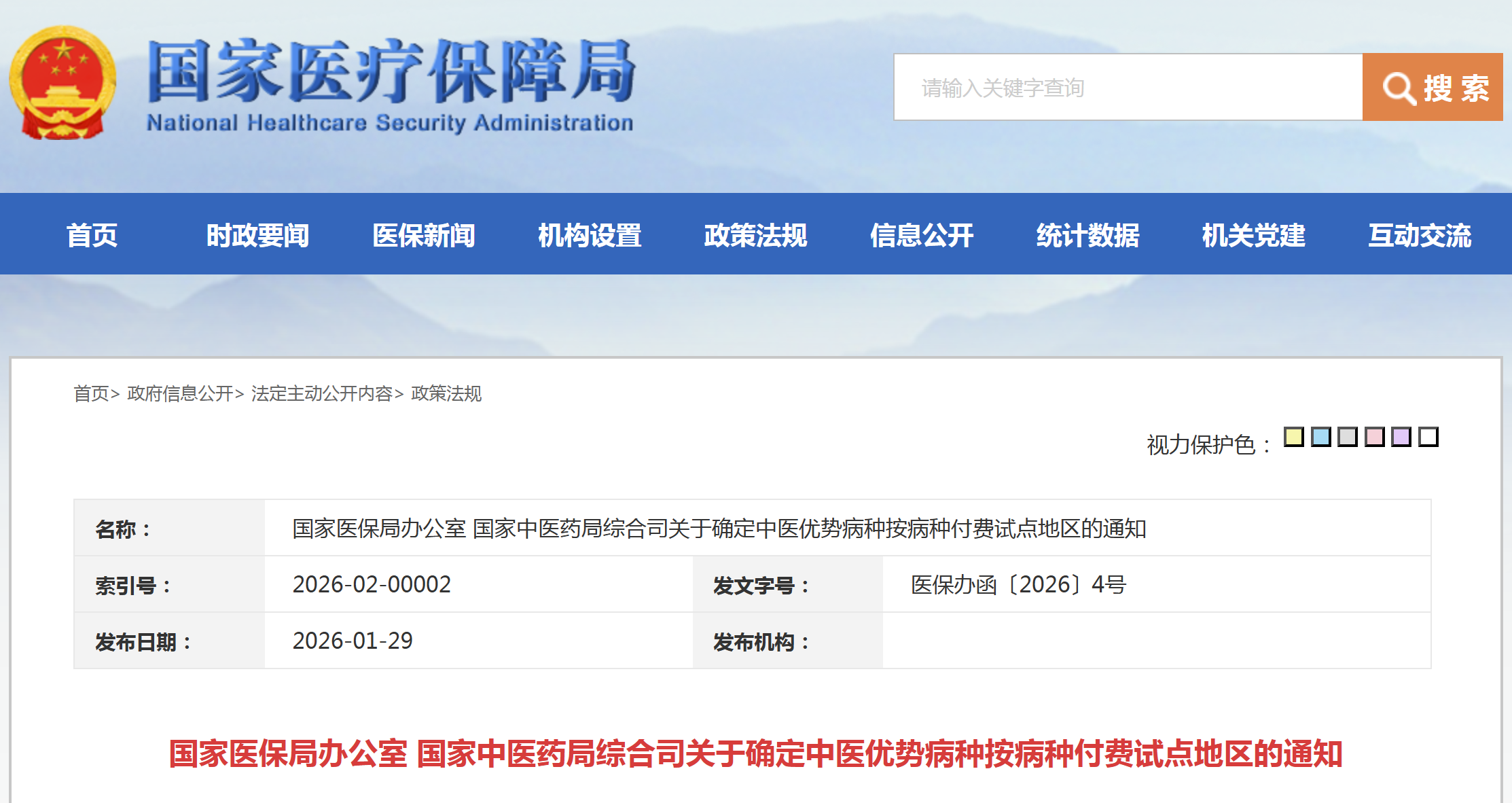
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46