自1988年起,美国FDA制定了多个新药加快审批计划,包括快速通道认定(1988)、加速审批(1992)、优先审评认定(1992),以加快患者需求的新药研发与审评。即便如此,由于现有的加快药品上市的机制通常要求药物研发的III 期临床试验数据,使得审评速度不足以满足众多迫切需要新药的患者的需求。2012 年《FDA 安全与创新法案》( the Food and Drug Administration Safety and Innovation Act,FDASIA) 获得通过,FDA 开始拥有突破性治疗药品认定(breakthrough therapy designation)这一新的工具,来有效促进药品研发。那么自2012年以来究竟有哪些新药获得了美国FDA突破性治疗药品认定呢?这些获得突破性治疗药品认定的新药具有哪些特点呢?
突破性治疗药品的定义及特点
美国《联邦食品、药品与化妆品法案》第506( a) 节对认定药品作为突破性治疗药品做出规定,“不论单独使用或与一个或多个其他药品联用,如果拟用于严重或威胁生命的疾病或病症的治疗,与现有治疗药品相比,并有初步临床证据可证明在一个或多个临床上有意义的终点上有显着改善。这种在临床研发早期观察到显着临床作用的药品即为‘突破性治疗药品’。” 突破性治疗药品具有如下特点:① 具备所有的快速通道认定特征;② 在IND (Investigational New Drug,临床研究申请)阶段对有效的药品开发强化指导,最早可适于I 期临床试验;③ 高级经理介入的组织承诺。
2012—2015年突破性治疗药品审批概况
图1 2012-2015年披露资料的72个获得突破性治疗药品认定新药疾病领域分布和年代分布
数据来源:Nat Rev Drug Discov. 2015 Sep;14(9):597-8
2012年7月截至2015年6月,美国FDA药物评价和研究中心( Center for Drug Evaluation and Research ,CDER)和美国FDA生物制品评价和研究中心(Center for Biologics Evaluation and Research, CBER)共收到309份突破性治疗药品申请。其中29%(90个)的突破性治疗药品申请获得批准,55%的申请被拒绝,16%的申请目前还没有明确结果(见图1)。在目前已经披露资料的72个获得突破性治疗药品认定的药物中,63%(45个)药物为抗肿瘤药、血液系统疾病药物和孤儿药。肿瘤、血液系统疾病和罕见病的研究中,一直不断发现新的疾病作用机制和新的药物靶点,同时由于目前缺乏有效的治疗手段,从而导致突破性治疗药品的比例较高。但是在某些疾病领域如心血管疾病、免疫系统疾病和内分泌系统疾病领域明显缺乏突破性治疗药品。 在过去2014年,大部分的突破性治疗药品被授予III期的药物(见表1)。
表1 2014年6月至2015年6月获得FDA突破性治疗药物认定的III期临床新药
数据来源:Nat Rev Drug Discov. 2015 Sep;14(9):597-8
FDA对突破性的治疗药品审批的特点分析
FDA对突破性治疗药品的认定与药物的适应症存在很大的相关性。慢性淋巴细胞白血病、囊性纤维化、病毒性丙型肝炎感染和特发性肺纤维化等病情较为严重、存在迫切的未满足的医疗需求的疾病,FDA较容易对新药授予突破性治疗药品认定,并希望通过突破性治疗药品认定能加快上市一批新药从而能解决这些非常迫切的医疗难题。例如,在2013-2014年共有4个慢性淋巴细胞白血病新药被授予突破性治疗药品认定,随后纷纷被FDA批准上市。这4个突破性治疗药品包括葛兰素史克公司研发的CD20特异性单克隆抗体Ofatumumab(2013年9月24日被批准用于慢性淋巴细胞白血病的治疗)、罗氏公司研发的CD20特异性单克隆抗体Obinutuzumab(2013年11月1日被批准用于慢性淋巴细胞白血病的治疗);两个靶向小分子药物即Pharmacyclics/Janssen公司研发的布鲁顿酪氨酸激酶抑制剂Ibrutinib(2014年02月12日被批准用于慢性淋巴细胞白血病的治疗)和Gilead公司研发的磷酸肌醇3激酶(PI3Kδ)抑制剂Idelalisib(2014年07月23日被批准用于慢性淋巴细胞白血病的治疗)。
相反FDA对一些治疗其他疾病的新药,对突破性治疗药品的认定则非常严格。例如, 针对间变性淋巴瘤激酶(Anaplastic Lymphoma kinase, ALK)的新药研究已经取得了一定的成果,如诺华公司研发的Ceritinib 2014年4月29日通过美国FDA上市用于ALK阳性非小细胞肺癌的治疗;罗氏公司研发的Alectinib 2014年在日本上市用于ALK阳性非小细胞肺癌的治疗;Ariad公司研发的AP26113目前处于II期临床,用于ALK阳性非小细胞肺癌的治疗。然而FDA在2013年8月拒绝了Ariad公司研发的AP26113突破性治疗药品认定的申请,原因是认为AP26113开展的治疗ALK阳性非小细胞肺癌的临床试验纳入受试者太少,随访时间相对较短。经过后期的资料补充和沟通,美国FDA在2014年10月授予了Ariad公司研发的AP26113突破性治疗药品认定,但是到目前为止Ariad公司尚未对AP26113提出新药申请。
对突破性治疗药品未来的展望
随着靶向治疗的日益发展,肿瘤药,血液系统疾病药物、孤儿药在未来依然将是突破性治疗药品认定最为集中的疾病领域。同时也期待免疫系统疾病药物和中枢神经系统疾病药物能出现获得突破性治疗药品认定的新药。
来源:新康界 作者:阿丽塔
为你推荐
 资讯
资讯 葛兰素史克新可来获批第四项适应症
今日,葛兰素史克中国宣布,中国国家药品监督管理局已批准新可来(美泊利珠单抗注射液)用于未充分控制的以血嗜酸性粒细胞升高为特征的慢性阻塞性肺疾病(COPD)成人患者的维持...
2025-12-22 21:11
 资讯
资讯 中国首个且目前唯一!长期体重管理药物诺和盈获批心血管适应症
12月22日,司美格鲁肽注射液(商品名:诺和盈®)的心血管适应症上市申请获得中国国家药品监督管理局(NMPA)批准,适用于降低已确诊为心血
2025-12-22 18:48
 资讯
资讯 加科思与阿斯利康就泛KRAS抑制剂JAB-23E73达成全球独家许可协议,里程碑付款最高可达20.15亿美元
12月21日晚间,加科思-B(01167)发布公告称,与阿斯利康就泛KRAS抑制剂JAB-23E73订立许可及合作协议。
2025-12-22 16:07
 资讯
资讯 国家药监局进一步明确《Q12:药品生命周期管理的技术和监管考虑》国际人用药品注册技术协调会指导原则的适用问题
对于ICH Q12中提供的监管工具批准后药学变更管理方案(PACMP),国家药监局药品审评中心已发布《化学药品批准后药学变更管理方案技术指导原则(试行)》,并将根据国际上执行IC...
2025-12-20 10:46
 资讯
资讯 特朗普宣布与安进、BMS等九家跨国药企达成协议,药价大幅降低
据当地时间周五美国白宫发布的消息,美国总统特朗普宣布与九家制药公司达成协议,这是一系列相关协议中的最新一批,这些协议旨在以降低部分美国人的药品价格来换取三年关税宽限期。
2025-12-20 10:29
 资讯
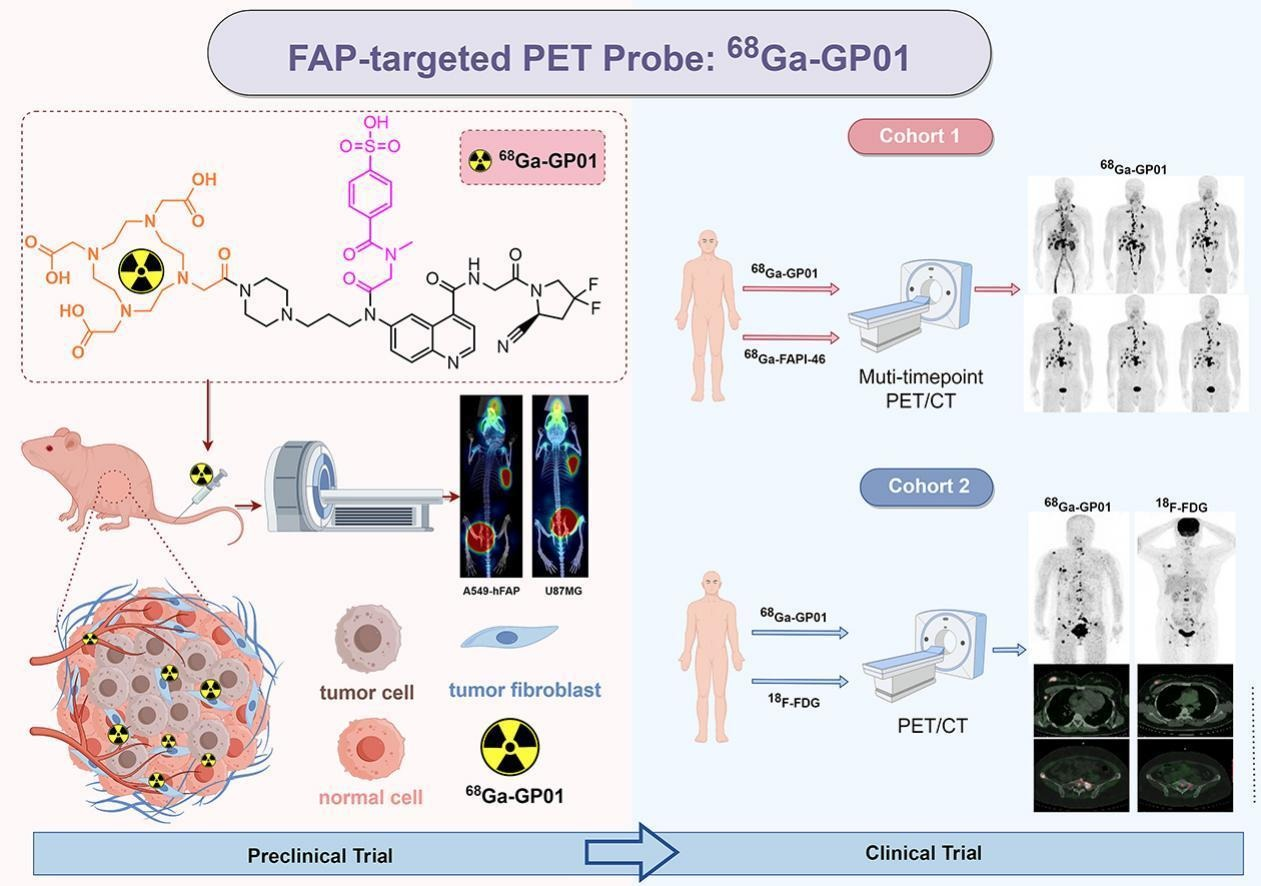
资讯 备思复联合帕博利珠单抗显著改善肌层浸润性膀胱癌患者的生存期,无论患者能否耐受顺铂
思复联合帕博利珠单抗成为首个且目前唯一不含铂类化疗的治疗方案,在顺铂耐受肌层浸润性膀胱癌患者膀胱切除术前后使用中,可改善无事件生存期和总生存期
2025-12-19 15:37
 资讯
资讯 我国60岁以上听损老人逾2000万
60岁及以上老年人群的听力损失患病率在各个年龄段当中居于首位,高达11 04%,据此推算,我国患听力损失的60岁以上老年人至少2000万人。约1 3的65岁以上老年人伴有听力残疾,约...
2025-12-18 21:44
 资讯
资讯 中国低卫生资源地区宫颈癌综合防控项目在内蒙古敖汉旗落地,筑牢抵御宫颈癌的防线
由中国癌症基金会发起、默沙东(默沙东是美国新泽西州 肯尼沃斯市默克公司的公司商号)支持的中国低卫生资源地区宫颈癌综合防控项目于内蒙古自治区赤峰市敖汉旗正式落地
2025-12-18 16:23
 资讯
资讯 安斯泰来将在2026年ASCO胃肠道癌症研讨会(ASCO GI)上公布其胃肠道肿瘤产品管线的最新临床数据
2期ILUSTRO研究评估佐妥昔单抗三药联合方案用于一线晚期胃癌和胃食管结合部(G GEJ)癌的队列结果入选最新突破性口头报告
2025-12-18 12:53
 资讯
资讯 加强基层医疗卫生机构儿科、妇科、康复医学科、精神(心理)科、五官(口腔)科等特色科室建设
在加强基层医疗卫生机构全科医疗科、中医科、预防保健科等业务及医技科室建设的基础上,综合考虑辖区居民健康需求、人口老龄化、区域医疗卫生资源布局等因素,重点加强若干临床...
2025-12-17 20:03