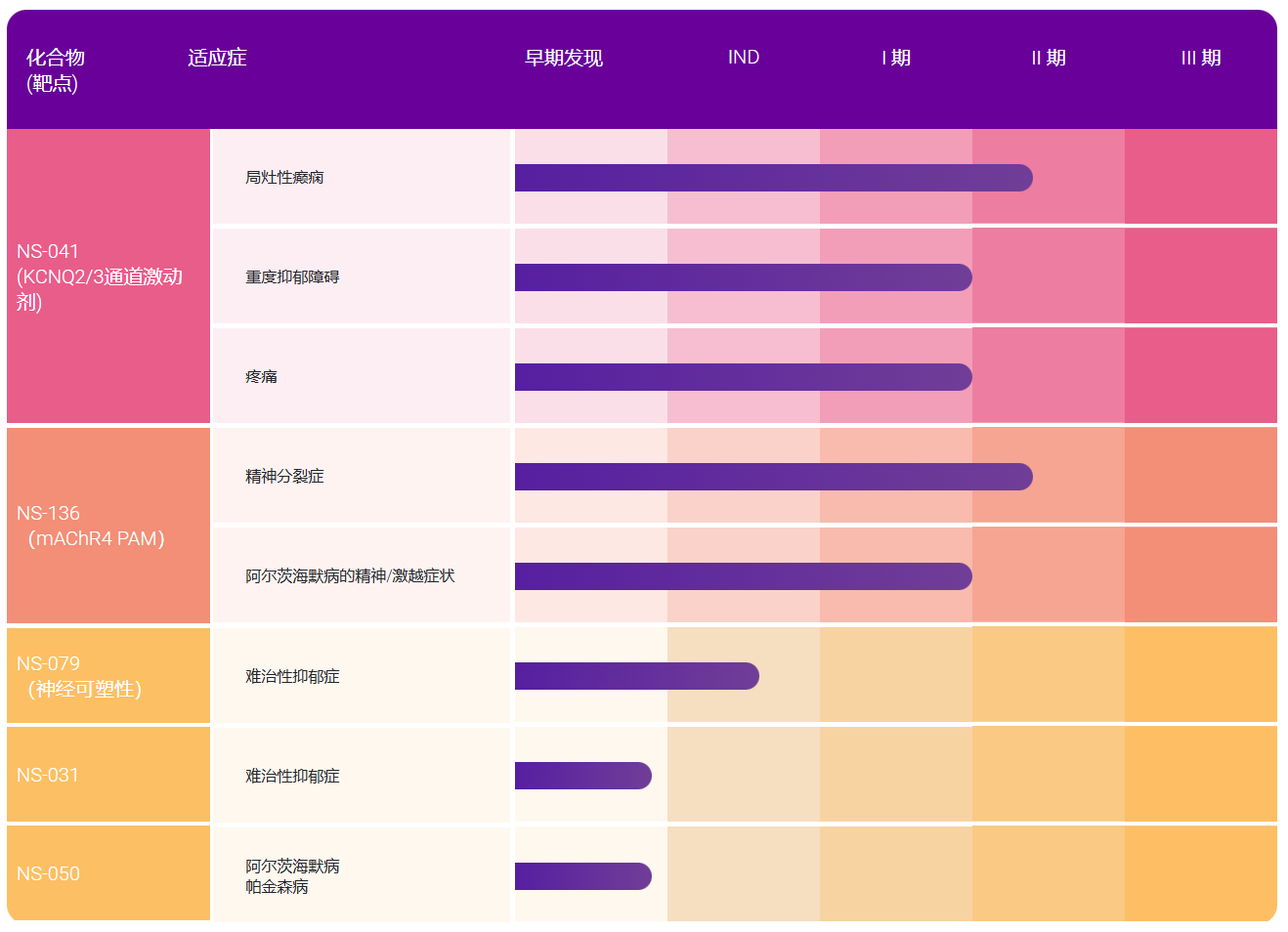
据BCC分析,2020年液态活检市场值将达220亿美元,目前已有多家公司和机构引进了循环肿瘤DNA(ctDNA)技术,准备进攻该市场。然而,这些企业在液态活检市场上走得并不顺利,面临着政府监管和技术发展障碍。
多家企业抢分液态活检市场
早在1948年研究人员就在人类血液中标识了人类DNA,1977年标识了癌症患者的血液DNA。2013年,香港中文大学 Dennis Lo博士开发了患者血浆游离DNA无创癌症检测技术。在Lo博士引领的试验启动前,意大利癌症研究治疗机构的Alberto Bardelli博士就对患者肿瘤DNA中的KRAS突变进行了研究,这些患者的肿瘤已对表皮生长因子受体抑制剂产生抗性。2014年,约翰霍普金斯癌症研究中心的研究人员发现,血液中由肿瘤脱落的DNA片段可用于无创性肿瘤早期检测、监测治疗反应及探索肿瘤抵抗治疗的原因。
目前约翰普金斯的一家公司,Personal Genome Diagnostics (PGDx)已开发了一个肿瘤筛选平台,包括全基因组测序、全癌症panels、目标panels、组织单基因分析、液态活检以及伴随诊断等,该公司在去年10月份获了2140万美元的A轮融资。致力于ctDNA检测的开发商还有Boreal Genomics、Trovagene和Natera等。
Boreal Genomics是血浆游离DNA突变检测分析产品OnTarget?的 开发者,Trovagene开发了尿液ctDNA分离技术、Natera所研发的技术被伦敦大学癌症研究所用于检测840名患者的ctDNA 突变,聚焦肺癌如何发生变异,如何对治疗产生耐药性。另外一家初创企业 Guardant Health于今年1月7日宣布关闭1亿美元的D轮融资。
今年1月份,世界领先基因测序公司Illumina对外宣称将创建一个新公司——Grail,致力于开发一种不超过1000美金的血液检测,用于多类型癌症的早期筛查。Illumina预计Grail于2019年上市,届时将作为测试中心与医院形成合作网络。
Grail公司发言人表示目前公司打算在2017年开始临床试验,“考虑到目前FDA正在讨论关于LDTs的监管,我们在等待FDA更新指南,Grail最有可能在2016年上半年推出最合适的策略以继续前进。继续前进意味着与FDA共同讨论最终的检测监管途径等问题。”监管途径包括明确测试开发商可研发的范围,明确什么样的检测验证机构认为符合标准等。
液态活检企业遭FDA质疑,行路难
去年9月份Pathway Genomics公司以299-699美元推出CancerIntercept Detect(癌症截获检测)产品,引起了FDA的愤怒。2015年9月21日,FDA书信通知Pathway公司的创始人及CEO Jim Plante,FDA表示该产品似乎满足设备所要求,因为它包含了血液采集管,然而他们对Pathway网站上发布的白皮书(声称该产品至少能检测出10种不同的癌症)表示质疑。
FDA体外诊断及放射保健部患者安全及产品质量办公室主任James L. Woods说,“我们认为Pathway公司提供了没有足够临床验证的高风险测试,且可能对公众造成危害。”Pathway公司对FDA的声明进行了反驳,“我们在测试开发的过程中已经进行了适当的验证测试,如今我们也在进行更多的研究。”
在FDA发表声明之后,Pathway公司针对CancerIntercept Detect产品启动了两项临床研究。其中一项研究将对1000名以上患者进行9种癌症驱动基因96个ctDNA突变检测,另外一项研究将对200名患者进行评估以判断ctDNA检测是否可检测癌症和癌前病变症状,这些患者同时将进行结肠镜检查。
Pathway公司CEO Plante表示,该公司还启动了关于CancerIntercept Detect?监视器的第三项临床研究。这三项研究都涉及了Li-Fraumeni综合征、肺癌和甲状腺癌的筛查。Plante说,“我们与FDA的对话仍在进行中,我们将与FDA会面并给与答复,我们希望在不久的将来达成一个协议。”然而,他拒绝透露如何回复FDA的质疑。
FDA坚称不想破坏ctDNA的发展或停止新技术的发展。FDA的发言人Eric Pahon说,“我们不想扼杀人们了解自身遗传信息的机会,但确保人们获得正确答案、确保测试的安全有效性也至关重要。”
FDA对Pathway公司的审查恰逢该机构发布高风险实验室检测(lab-developed tests,LDTs)最终指导计划的关键时期,虽然FDA的指南草案对盈利诊断机构的研发人员更有利,但盈利机构与非盈利机构都对此发出反对的声音。
FDA发言人Pahon说,“如果一种测试未花费一点时间和金钱来通过FDA的评估测试就能存活在市场上,且给开发商带来金钱效益,那么这看起来非常有吸引力,但这也是LDTs管理的必要性。”
液态活检发展面临两个障碍
监督审查是ctDNA检测需要克服的第一个障碍,另外一种障碍是解决技术发展面临的悬而未决的问题。
生命科学/医药行业高级执行董事Harry Glorikian说,“第一个问题是ctDNA检测的最终对象是否为无症状且也不会发展为癌症的患者?这会对非严重患者带来不必要的治疗。”
“给干预确定一个阈值,这将更加困难”,Glorikian说,“如同大海捞针,检测的敏感度是否够?是否能精确排除癌症?是否揭示组织的来源?该组织是否是原发肿瘤部位或转移灶?”
Glorikian补充到,“另一个挑战包括分离DNA的标准,涉及覆盖深度、生物标志物的选择、结果的可重复性以及不明变体的影响,这些都需要大型前瞻性试验进行验证。”
健康行业资深分析师Frost & Sullivan说,“由于肿瘤负荷、肿瘤发展阶段、细胞流动等影响,ctDNA是高度可变的,因而高灵敏度也是至关重要的。”
Ravishankar说,“对于ctDNA检测,第三个突出的问题是临床证据:突变效用性的证据、当前检测ctDNA的敏感性、当前技术繁琐的工作流程,而解决这三个问题又会带来其他的问题。”
来源:生物探索
为你推荐
 资讯
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22
 资讯
资讯 箕星药业宣布成功完成D1轮2.87亿美元融资,推进口服GLP-1药物开发
1月22日消息,箕星药业有限公司(Corxel Pharmaceuticals Limited)宣布已成功完成D1轮融资,募集资金高达2 87亿美元。
2026-01-23 18:00
 资讯
资讯 基因启明完成亿元天使轮融资,加码iNKT细胞疗法研发与临床转化
本轮融资由人合资本独家投资。融资资金将重点用于推进公司核心iNKT细胞药物的临床试验进程,同时加速新管线的研发拓展与技术平台升级。
2026-01-23 14:05
 资讯
资讯 商务部、国家发改委、国家卫健委、国家医保局等9部门印发促进药品零售行业高质量发展的意见
鼓励符合监管要求的实体医疗机构、互联网医院与药品零售企业依托电子处方流转平台进行处方流转。鼓励建设非医保药品自费处方电子流转平台,规范和完善相关药学服务。
2026-01-23 11:04