全球独立制药集团施维雅公布了2023/24财年的财务业绩,重点回顾了本财年的里程碑事件。
施维雅集团总裁Olivier Laureau表示:“鉴于集团在2023-2024财年的稳健业绩表现,我们上调了2030年战略雄心的业绩目标。业绩成果充分证明,采用差异化创新来服务患者的战略让我们在以下三大关键领域均取得了成功。在心血管代谢和静脉疾病领域,我们巩固了全球领先地位,并持续推进渐进式创新战略。在肿瘤学领域,凭借去年多项罕见肿瘤治疗药物获批上市,我们成为了该领域的创新者。聚焦于未被满足的患者需求,神经科学是集团第三大治疗领域,并且未来将成为集团的增长引擎。2023-2024财年的表现标志着我们正在加速向前迈进,实现2030年战略目标。”
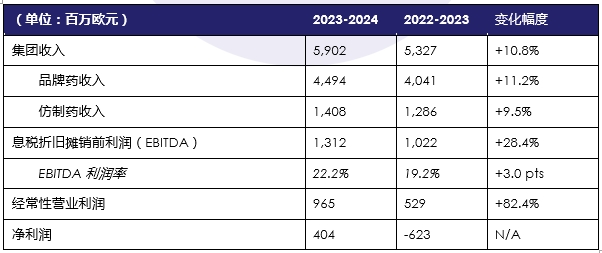
经审计的合并利润表摘要[依据国际财务报告准则(IFRS),截至2024年9月30日]
施维雅集团2023-2024财年的合并收入达59.02亿欧元,较2022-2023财年增长10.8%。集团业绩的主要增长动力来自品牌药和仿制药在全球范围的销售增长,尽管受到货币汇率为-3.5%的影响(即2023-2024财年货币汇率导致收入减少1.85亿欧元,而上一财年货币汇率导致收入减少1.32亿欧元),对比上一财年仍实现了12.6%的销量增幅。集团已经成功地减少了某些国家通胀所带来的影响,为本财年带来了1.7%的积极影响,相比之下,在2022-2023财年为0.6%。
2023-2024财年,品牌药总收入为44.94亿欧元,较2022-2023财年增长11.2%。2023-2024财年,集团的仿制药收入同比增长9.5%,达到14.08亿欧元。
2023-2024财年,集团的息税折旧摊销前利润(EBITDA)为13.12亿欧元,息税折旧及摊销前利润率为22.2%,而2022/2023财年为19.2%。这一强劲增长归功于药物销售收入的增加,特别是在肿瘤学领域的显著增长,以及本财年整个集团谨慎的支出控制。2023-2024财年的合并净收入为4.04亿欧元,相较于上一财年亏损6.23亿欧元实现了强劲反弹。
基于本财年业绩表现,集团决定上调2030战略的财务目标。施维雅目前计划到2030年实现100亿欧元的年销售收入,细分如下:
▪ 品牌药年销售收入80亿欧元(原定为60亿欧元),其中40亿欧元来自心脏代谢和静脉疾病领域,40亿欧元来自肿瘤学和神经科学领域;
▪ 仿制药年销售收入20亿欧元;
▪ EBITDA目标利润率不低于30%。
施维雅集团财务执行副总裁Pascal Lemaire表示:“施维雅集团2025年目标中的绝大部分已经提前达成,包括肿瘤学业务收入突破10亿欧元,以及EBITDA达到13亿欧元。优异的表现证明了我们成功的转型轨迹,继而能够为2030战略设定更具雄心的业务目标。我们的现有目标是到2030年达到总收入100亿欧元,从而加快我们的增长势头,确保集团的独立性和为患者创造价值的能力。”
国际销售收入增长强劲,美国成为集团排名首位的子公司
非欧盟市场销售收入占集团总收入的56.8%。美国子公司的品牌药收入居集团首位,2023-2024财年达8.79亿欧元,相较于2022-2023财年的6.35亿欧元增长38.4%。美国市场目前占集团销售总收入的15.2%,这一市场的增长为施维雅在美国的战略提供了重要支撑,尤其是在肿瘤学领域。根据美国患者组织发起的PatientView调研排名,施维雅集团在14个类别中的12项排名第一。这是法国制药公司首次取得这一成绩,凸显了施维雅与患者及患者组织密切合作的成果,并进一步体现了我们的使命:致力于推进治疗领域的进展,服务于患者的需求。
得益于集团在中国和日本分别取得了肿瘤学领域的全新里程碑,亚洲市场占集团销售总收入14.6%,较2022-2023财年增长了4%。2023年12月,施维雅从基石药业获得了拓舒沃®(Tibsovo®)在大中华区和新加坡的开发和商业化的独家权利,从而拥有该产品在全球范围内的所有权利。此前,施维雅已经于2022年4月在中国获得易安达®(Onivyde®)的上市批准,这是二十三年来首个获批用于治疗转移性胰腺癌的药物。2023年10月,施维雅在日本开始上市Oncaspar®,用于治疗急性淋巴细胞白血病和恶性淋巴瘤。施维雅在日本也于2024年6月提交了拓舒沃®用于急性髓系白血病的上市许可申请。
欧盟市场销售收入占集团总收入的43.2%,较前一年度增长10.2%。特别是在法国,品牌药销售收入达到1.87亿欧元,占集团合并销售收入的3.2%。自2017年以来,集团在法国的投资接近10亿欧元,体现了施维雅深耕法国市场、持续创造价值的坚定决心。集团位于法国卢瓦雷地区的生物生产机构Bio-S的落成便是一个重要例证。目前施维雅95.8%的原料药均在法国生产。
2023-2024财年,集团通过分布在世界各国的14个生产基地所组成的产业化网络,共计销售近13亿盒药物。
集团各治疗领域的成功转型
施维雅集团在心血管代谢和静脉疾病领域继续保持全球领先地位
施维雅在高血压治疗领域位于全球制药领先梯队,在心脏病学领域排名第五 。2023-2024财年,心血管代谢和静脉疾病领域业务占集团合并销售收入的49%。这一领域强劲的销售表现归功于渐进式创新和开发单片复方制剂(固定剂量复方制剂),这些创新方案让患有多种慢性病的患者能够通过服用一粒药同时接受多种治疗。Triplixam®是全球处方量最大的高血压三联治疗药物 ,2023-2024财年的销售收入达到2.93亿欧元。配合这一创新治疗方案,集团采取了包括发展中国家的广泛区域覆盖策略。
在2024年欧洲心脏病学会年会上,施维雅展示了一项国际III期多中心QUADRO临床研究结果 ,其为顽固性高血压患者带来了一系列重要进展。该研究旨在评估四联药物固定剂量组合的疗效与安全性,这能够为控制顽固性高血压以及改善患者依从性提供新的解决方案。2025年1月,施维雅向多个欧洲药品监管机构提交了其作为首个四联疗法的上市许可申请。
此外,爱脉朗® (治疗静脉淋巴功能不全)连续第四年成为集团的领军药物,在2023-2024财年实现销售收入6.22亿欧元。爱脉朗®成为价值和销量均居世界领先地位的静脉治疗药物 。
肿瘤学领域:精准、高效的发展战略
2023-2024财年,施维雅在肿瘤学领域获得了多项药物上市许可,印证集团致力于为患者需求庞大的罕见肿瘤开发新治疗方案的决心。
施维雅获得欧盟委员会批准将易安达®(Onivyde®)作为转移性胰腺癌的一线治疗药物。此外,集团还获得了美国食品药品监督管理局(FDA)对Voranigo®的上市许可,用于携带IDH1 和IDH2突变的 2 级星形细胞瘤或少突神经胶质瘤的 12 岁及以上成人和儿童患者的手术(包括活检、次全切除术或全切除术)后治疗 。对于近25年来在这一领域未获得新的治疗方案的患者而言,这是肿瘤治疗领域的重大进展。Voranigo®同时也在奥比斯项目 (Project Orbis)国家(包括以色列、澳大利亚、加拿大和瑞士)以及阿联酋获批上市。
肿瘤学领域的销售收入为14.30亿欧元(对比2022/2023财年,增长33.0%),占集团2023-2024财年合并收入的24.2%,较2022-2023财年的20.2%有所提升。Voranigo®上市及其他治疗领域进展成为关键里程碑,集团将基于此提高2030战略中有关肿瘤学领域的目标。
施维雅有近70%的研发预算投入到肿瘤学领域,针对医疗需求尚未满足的癌症,提供八种药物用于患者治疗。此外,集团在肿瘤学领域的投资打造了前景广阔的研发管线,目前有30个肿瘤学研发项目(截至2025年1月),其中11个项目有潜力成为“同类首创疗法”(具有全新独特作用机制的药物)。
在2024年由肿瘤患者组织发起的制药企业声誉PatientView 调查中,施维雅继续稳居前三名,并首次在“透明度”、“超越药物的服务”和“研发”三项指标中排名第一。
神经科学:作为未来增长引擎的集团第三大治疗领域
过去30年来 ,由于全球人口增长、老龄化以及多种风险因素的增加,神经系统疾病的患病人数显著上升。截至2021年,全球共有超过30亿人 (即全球三分之一以上的人口)被诊断患有神经系统疾病,这类疾病成为全球致病和致残的主要原因。尽管医疗需求日益增长,但能够改变神经系统疾病进程或显著缓解相关症状的治疗手段仍然非常有限。
作为集团2030战略的一部分,施维雅致力于投入到这些未被满足的重要医疗需求,在肿瘤学领域的研发之外,决定将部分研发力量聚焦于神经科学领域,影响儿童和成人的神经系统疾病均已纳入神经科学研究范围。
目前的研发重点是主要与遗传和/或免疫炎症机制相关的三类神经系统疾病,包括难治性癫痫、罕见运动障碍和神经肌肉疾病。
不同的疾病之间有一些共同点,这为制定协同策略提供了可能,提高新药研发的成功率和研发速度。此外,受影响的患者通常在重点专病多学科诊疗中心由相同的专家进行诊疗。
施维雅的研发工作旨在针对这些疾病少数的共同作用机制,找到一种有效的策略,能够减缓或阻止疾病进展,或者能防止症状的发生,具体取决于疾病情况。集团的神经科学研发重点是小分子药物,主要靶向信使RNA(mRNA),包括反义寡核苷酸(ASOs),在这方面施维雅设立了专门的研发平台,还涵盖了药理学分子和单克隆抗体。
施维雅计划投入大量资源和资金(用于研发和业务拓展),在神经科学领域建立一个强大而前景广阔的研发管线,特别是在开发新药方面,着力满足往往可能带来毁灭性影响的神经系统疾病的重大而迫切的医疗需求。迄今为止,集团的管线包括8个研究项目和1个开发项目。
施维雅集团研发执行副总裁Claude Bertrand表示:“2023-2024财年的优异业绩证明了我们在加速发现、开发和交付创新治疗方案给患者的实力。这些进展归功于以患者需求为中心的战略、数字技术的运用、开放创新的方式,以及最重要的是,研发团队对服务患者前所未有的承诺。作为一家由基金会管理的独立制药集团,施维雅独立决策,拥抱长期愿景,我们将以肿瘤学领域的成功为基石,加大神经科学领域的研发力度从而更好地满足患者需求。”
仿制药业务为患者、集团及合作伙伴创造更大价值
集团的仿制药业务在2023-2024财年仍实现了9.5%的增长,销售收入达14.08亿欧元,充分证明集团在这一领域的战略行之有效。施维雅目前拥有超过1500种仿制药,涵盖了绝大多数疾病。这些药物通过三家子公司——东欧Egis制药、巴西Pharlab以及法国Biogaran,远销世界各地。
来源:医谷网
为你推荐
 资讯
资讯 降 HbA1c 超 2.5%且多重获益,华东医药国产降糖新药HDM1005降糖2期数据揭晓
本次研究为一项在饮食和运动或二甲双胍治疗后血糖控制不佳的2型糖尿病受试者中评价HDM1005注射液有效性和安全性的多中心、随机、盲法、平行、安慰剂和阳性对照的Ⅱ期临床研究
2026-03-10 19:38
 资讯
资讯 艾凯生物完成A3轮超亿元融资,加速AI驱动iPSC细胞治疗与类器官平台升级
本轮融资由知壹投资与沃杰资本联合领投,联新资本持续追加投资,资金将重点用于推进AI驱动的iPSC细胞治疗产品临床转化,加速完善iPSC细胞治疗与类器官两大核心技术平台布局。
2026-03-10 18:22
 资讯
资讯 中科搏锐斩获数千万B轮融资,推动脑机接口全产业链产业化落地
本轮融资由国内知名投资机构三泽创投独家投资,凯乘资本担任长期独家财务顾问,所筹资金将全力支撑公司深化脑机接口全产业链布局,加速尖端技术的临床转化与产业化落地。
2026-03-10 18:03
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41
 资讯
资讯 新一代 cAMP 偏向型 GLP-1 受体激动剂埃诺格鲁肽(先维盈)获批用于中国成人体重管理
在一项大型III期临床研究中展现出具有临床意义的减重效果:治疗48周时,受试者的平均体重下降达15 4%,其中92 8%的受试者实现了5%以上的体重减轻。
2026-03-06 12:38
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32