仿制药质量和疗效一致性评价工作中
改盐基药品评价一般考虑
(征求意见稿)
为贯彻《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的精神,国家食品药品监督管理总局发布了《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)和《普通口服固体制剂参比制剂选择和确定指导原则》等多个技术指导原则,本文是上述指导原则的补充文件。
改盐基药品系指制剂中使用的原料药在美国、欧盟或日本均未获准使用或无法确定含有相同原料药的参比制剂的药品。
本文件适用于仿制药质量和疗效一致性评价工作中适应症相同的改盐基药品的评价,包括但不限于本文件中描述的内容。
一、概述
不同药品如果活性成分相同,仅成盐形式不同,称为改盐基药品,包括改变已知盐类活性成分的酸根、碱基或金属离子,对游离形式药品成盐或把成盐药品改为游离形式等原料药与制剂。
原则上讲,通过改变成盐形式制成的药品应不改变其药理作用,仅改变其理化性质(如溶解度、稳定性等),以适应储存、生产或临床用药的需要。但是,每种不同成盐形式的药品都是具有独特化学性质和生物活性的化合物,其理化性质改变后,可引起药理作用程度或性质、体内过程的改变(如溶解度改变可影响药品的体内吸收,甚至体内药动学过程也会因此有所变化),从而影响药品的药效作用强度、作用位点和持续时间,有的甚至出现新的毒性、活性或适应症改变,其临床疗效和药品的安全性也不尽相同。对此类药品进行再评价是仿制药质量与疗效一致性评价工作的重要组成部分。
二、评价内容
改盐基药品包括原料药与制剂。对改盐基药品的有效性和安全性评价应以被改盐基药品为对照,进行对比试验,并对二者在各项目的异同与优劣进行评价。研究内容主要体现在以下几个方面:
(一)改盐基的科学性和合理性
从药品的理化性质、生物学特性、临床需要等方面分析论证改盐基药品的科学性、合理性和必要性。
(二)药学研究
药学研究均要求与被改盐基药品对照,进行对比试验,并对改盐基药品与被改盐基药品在各项目的异同与优劣进行评价。改盐基药品质量应与被改盐基药品的参比制剂质量相当。研究内容主要为以下几个方面:
1.原料药
1.1结构鉴定:按照化学药品新注册分类2.1类要求进行结构确证,应提供充足的成盐证据。
1.2理化性质:应进行理化性质的系统研究并与被改盐基药品进行比较,重点关注下述对比试验数据:溶解度(不同pH、不同溶剂等)、pKa(pKb)、吸湿性(临界相对湿度及吸湿曲线)、晶型等。应尽可能提供详细的被改盐基药品理化性质文献信息。
1.3质量控制:应进行与安全性、有效性有关的各项目的系统研究并进行比较,重点关注有关物质结构确证的严谨性,杂质分析方法的科学性与合理性、杂质的产生途径以及杂质水平等对比试验数据,尤其是否有新增杂质及其杂质水平与毒性,对于存在潜在安全风险的盐基(如甲磺酸盐等)进行系统研究与控制,说明杂质限度制订的依据。
1.4稳定性试验:应进行各质控项目试验的比较和分析,重点关注性状、晶型、有关物质、含量测定等。
2.制剂
2.1剂型及产品组成:不同成盐方式对药品的理化性质可能有很大影响,理化性质对于剂型选择和确定生产工艺非常重要。应关注剂型与规格的选择依据,以及处方组成、生产工艺、包装材料选择和确定的合理性,注意与被改盐基的参比制剂的比较。
2.2原辅料的控制:(1)分析与制剂生产及制剂性能相关的原料药的关键理化特性(如晶型、不同pH条件下溶解性、粒度分布、pKa、logP等)及其控制;说明是否进行了原料药和辅料的相容性试验及依据;如进行了原料药和辅料的相容性试验,简述试验情况,包括试验设计、考察指标、试验结果等。(2)简述辅料是否适合所用的给药途径,结合辅料在处方中的作用分析主要辅料与制剂性能相关的关键特性。如有变更,对变更处方后辅料的合理性以及处方的合理性进行分析研究。
2.3质量控制:应进行与安全性有效性有关的各项目的系统研究与比较,重点关注有关物质结构确证的严谨性,杂质分析方法的科学性与合理性、杂质的产生途径以及杂质水平等对比试验数据,尤其是否有新增杂质及其杂质水平与毒性等,对于存在潜在安全风险的盐基(如甲磺酸盐等)进行系统研究与控制,说明杂质限度制订的依据,以及溶出曲线等能反映其剂型特点的关键项目的对比试验。
2.4稳定性试验:应进行各质控项目试验的比较和分析,重点关注性状、溶出曲线、有关物质、含量测定等。
(三)非临床研究
因改盐基药品已上市并用于临床治疗,一般情况,体内药理活性成分相同,原则上不再开展非临床药效学和毒理学研究。
分析改盐基药品与被改盐基药品相比,是否增加了与盐基相关的潜在安全风险。重点关注:成盐药品的毒性是否与成盐时结合的阴阳离子有密切关系;成盐的制备过程中是否可能产生新的潜在的毒性杂质;体内是否可能产生毒性代谢物。必要时按照化学药品新注册分类2.1类要求进行毒理学研究。
(四)生物等效性试验或临床试验
以等效为立题依据的改盐基药品,开展与被改盐基药品参比制剂的生物等效性研究;以优效为立题依据的改盐基药品,建议以被改盐基药品作为参比制剂,进行药代动力学研究、药代动力学研究/药效动力学研究和(或)相应的临床试验。
三、其他
其他未尽事宜请参照国家食品药品监督管理总局《关于发布化学药品新注册分类申报资料要求(试行)的通告》(2016年第80号)、《关于发布化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)的通告》(2016年第120号)、《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(通告2016年第61号)和《仿制药质量和疗效一致性评价临床有效性试验一般考虑》(待发)等有关文件进行。
来源:CFDA
为你推荐
 资讯
资讯 上海医药iNKT细胞注射液获批临床试验
1月20日,上海医药集团股份有限公司发布公告称,下属上海医药集团生物治疗技术有限公司自主研发的“B023细胞注射液”收到国家药品监督管理局核准签发的《药物临床试验批准通知书...
2026-01-20 16:49
 资讯
资讯 蚂蚁阿福升级PC端,面向医生群体上线 DeepSearch功能
今日,蚂蚁阿福升级其 PC 端,并上线DeepSearch(深度搜索)功能打造中国版“Open Evidence”,免费为医生、医学生及基层医疗工作者等泛医学人士提供专业服务。蚂蚁阿福 PC...
2026-01-20 15:56
 资讯
资讯 可突破血脑屏障,FDA受理非小细胞肺癌创新药上市申请
近日,美国生物医药公司Nuvalent宣布,美国FDA已受理其为zidesamtinib递交的新药申请(NDA)
2026-01-20 11:41
 资讯
资讯 核药创新再破局!远大医药TLX591-CDx国内NDA获受理
远大医药(0512 HK)再度传来核药重大利好——公司用于诊断前列腺癌的创新放射性核素偶联药物(RDC)TLX591-CDx向国家药监局递交的新药上市申请(NDA)已获受理。
2026-01-19 21:29
 资讯
资讯 eCTD验证软件更新V1.1.0版,3月1日起,V1.0版及配套操作手册将不再适用
本次更新内容主要包括新增原料药申请验证规则,调整PDF文件书签、超链接和文件大小验证规则、完善部分文字描述等。
2026-01-19 14:18
 资讯
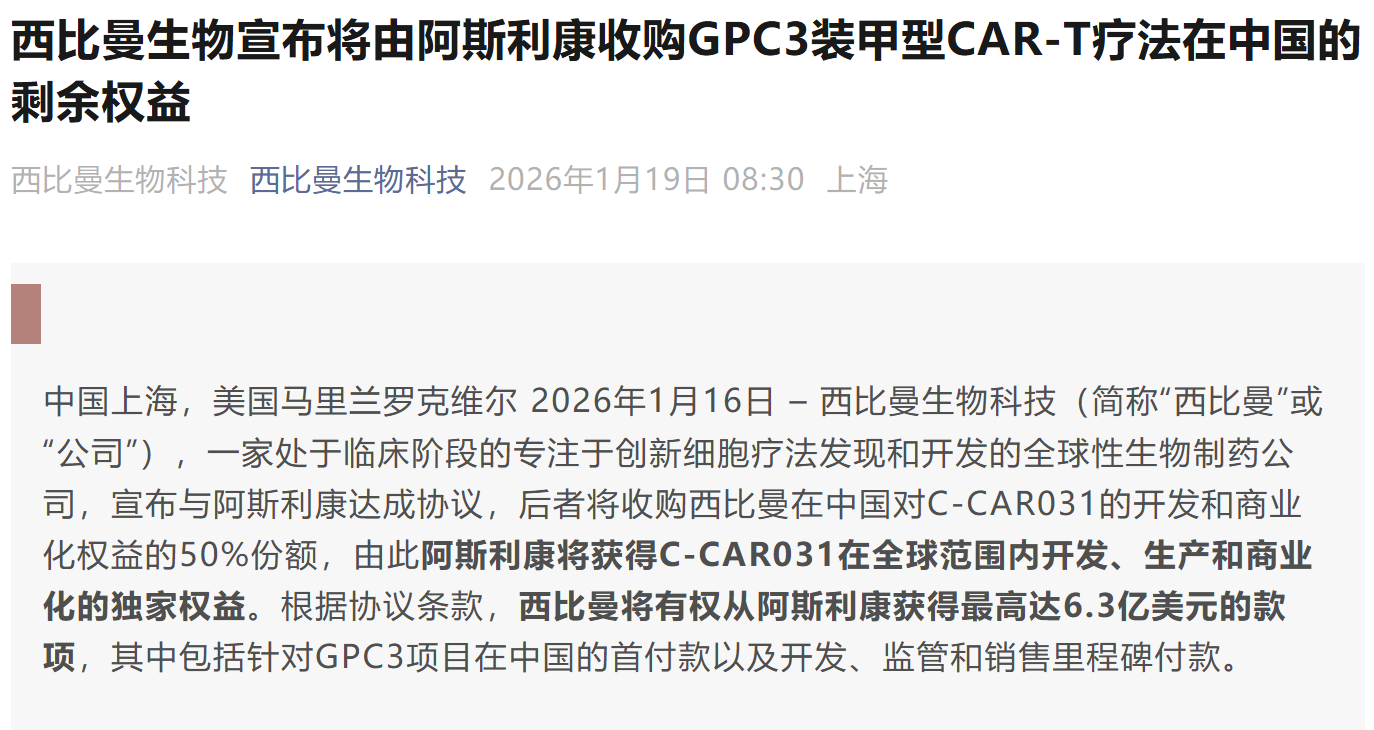
资讯 阿斯利康获得西比曼靶向GPC3细胞疗法剩余50%的全球权益
1月16日,西比曼生物科技宣布与阿斯利康达成协议,后者将收购西比曼在中国对C-CAR031的开发和商业化权益的50%份额,由此阿斯利康将获得C-CAR031在全球范围内开发、生产和商业化...
2026-01-19 13:19
 资讯
资讯 2025年国民经济数据:16—59岁人口85136万人,占全国人口的比重为60.6%;60岁及以上人口32338万人,占全国人口的23.0%
全年出生人口792万人,人口出生率为5 63‰;死亡人口1131万人,人口死亡率为8 04‰;人口自然增长率为-2 41‰。
2026-01-19 11:41
 资讯
资讯 2026年1月14日起,均适用《Q8、Q9和Q10问答(R5)》国际人用药品注册技术协调会指导原则
自2026年1月14日起开始的相关研究,均适用《Q8、Q9和Q10问答(R5)》。
2026-01-19 11:24
 资讯
资讯 糖尿病治疗1类创新药奥洛格列净胶囊获批
1月16日,国家药监局官网信息显示,近日,国家药品监督管理局批准宜昌东阳光长江药业股份有限公司申报的1类创新药奥洛格列净胶囊(商品名:东泽安)上市,该药适用于改善成人2型...
2026-01-17 23:20
 资讯
资讯 CDE:中药复方制剂新药研发人用经验收集整理技术指导原则(试行)
人用经验是“三结合”中药注册审评证据体系的重要环节。如何产生可评价的人用经验、怎样收集整理人用经验数据,对于筛选确定临床有效处方、合理利用人用经验支持后续研发及决策...
2026-01-16 21:09
 资讯
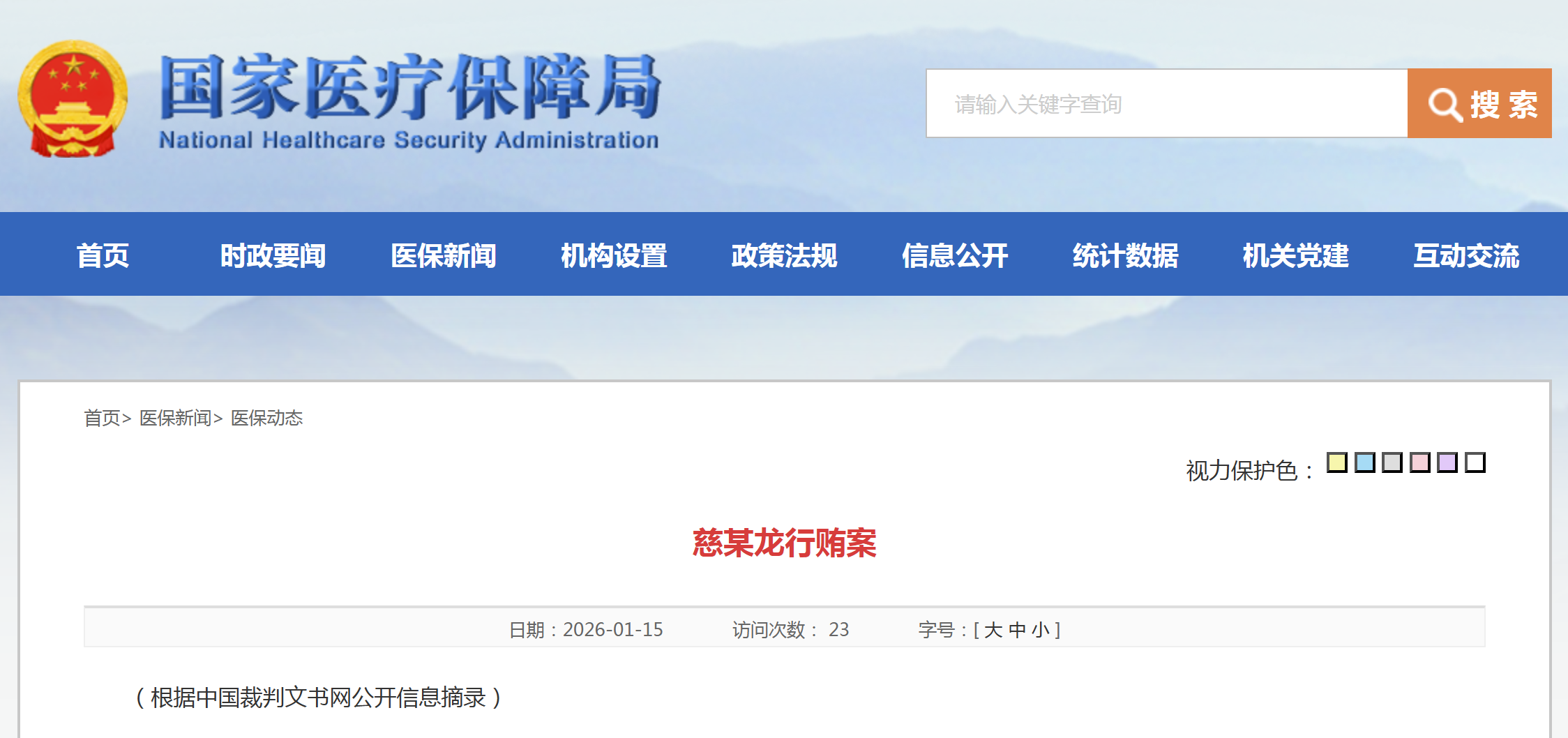
资讯 国家医保局再发布两起行贿案例
继发布《医药咨询服务企业涉商业贿赂案》和《党某海犯非国家工作人员受贿罪案》后,国家医保局再次发布《慈某龙行贿案》和《重庆康荣医疗设备有限公司涉商业贿赂案》。
2026-01-15 11:49
 资讯
资讯 阿斯利康收购AI制药公司Modella AI
美东时间,本周二,阿斯利康在摩根大通医疗保健大会上宣布,已收购总部位于波士顿的Modella AI,这是首次有大型制药公司全面吸收一家专业人工智能公司。
2026-01-14 17:21
 资讯
资讯 甘李药业甘精胰岛素获欧盟上市许可,将于赛诺菲同台竞争
1月14日,甘李药业盘后发布公告,甘李药业股份有限公司及其欧洲全资子公司甘李药业欧洲有限责任公司(Gan & Lee Pharmaceuticals Europe GmbH,以下简称“甘李欧洲”)于近...
2026-01-14 16:52
 资讯
资讯 第六批国家高值医用耗材集采药物涂层球囊类、泌尿介入类中选结果公示
1月14日,国家组织高值医用耗材联合采购办公室发布国家组织药物涂层球囊类、泌尿介入类医用耗材集中带量采购中选结果公示,即第六批国家高值医用耗材集采。
2026-01-14 14:44








