3月11日,国务院联防联控机制综合组印发《新冠病毒抗原检测应用方案(试行)》,决定推进“抗原筛查、核酸诊断”的监测模式,在核酸检测基础上增加抗原检测作为补充,明确社区居民有自我检测需求的,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测。
新冠病毒感染病例的早发现和早治疗对疫情的防控至关重要,采用规范的诊断流程和快速、灵敏的检测方法是及时发现病例、控制疫情的关键,新冠病毒抗原自测产品可缩短检测时间,有利于病毒的早发现,成为核酸检测的有效补充。截止目前,国家药监局已批准19款新冠抗原检测试剂盒,在3月21日印发的《关于切实做好当前疫情防控医疗保障工作的通知》中,还明确各省级医保部门要按程序将新冠病毒抗原检测试剂及相应检测项目临时性纳入本省份基本医保医疗服务项目目录。
随着首批“自测版”新冠抗原检测试剂盒的陆续获批上市,业内分析认为,抗原检测在国内具有潜在的蓝海空间,现阶段,国内多家企业在进行相关产品研发,位于张江科学城上海国际医学园区的默禾医疗也是其中之一。
已获得欧盟认证
作为一家从事医疗领域快速与个性化产品开发的高科技生物公司,默禾医疗旗下囊括了微生物检测产品、伴随诊断产品、肿瘤产品三大业务管线,正在进行国内申报的新冠抗原检测产品就属于微生物检测产品管线中的一员。
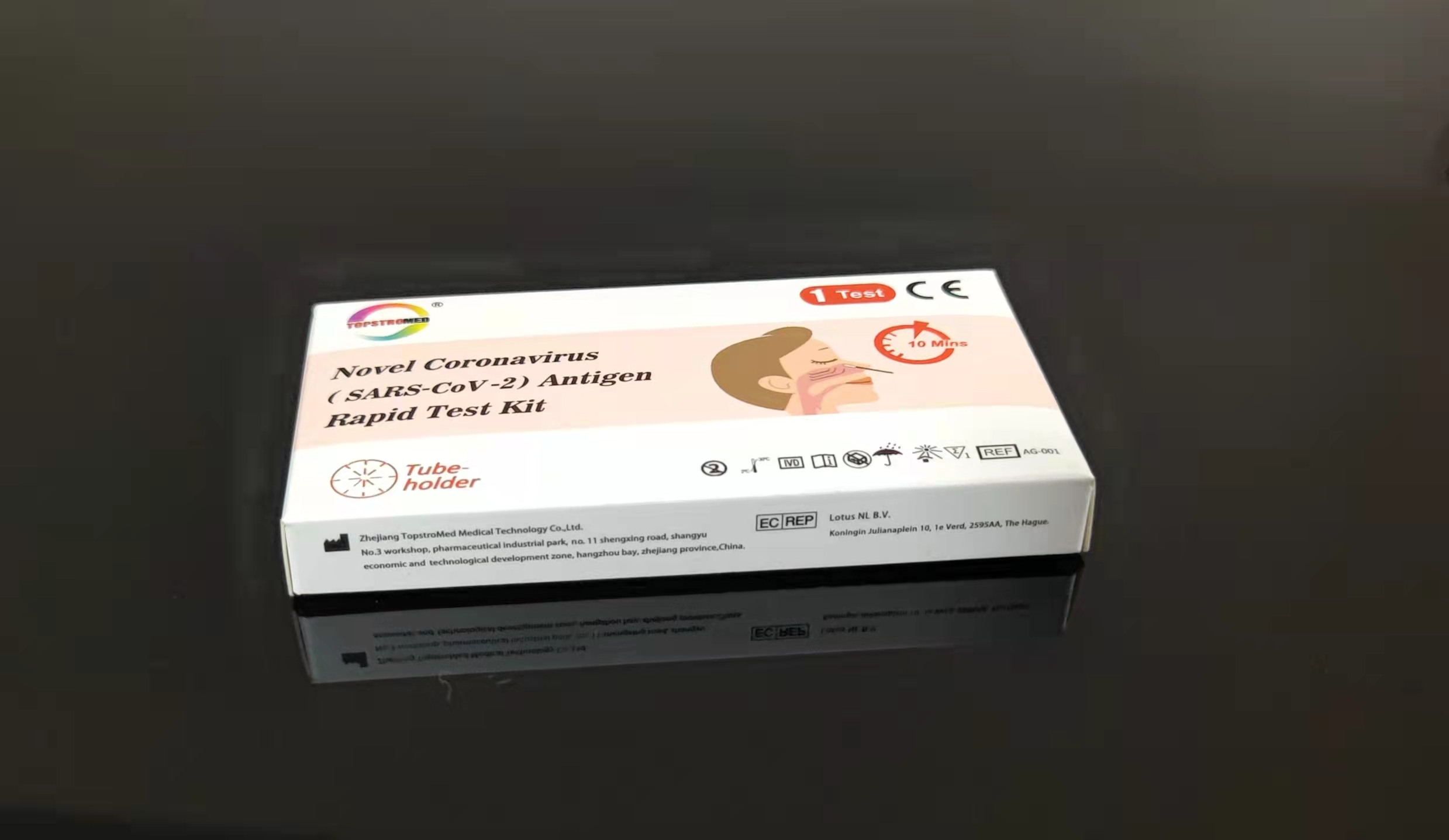
据了解,默禾医疗研发的新冠抗原检测试剂盒采用双抗夹心法和胶金体免疫层析法原理,用两种特异性强、灵敏度高的SARS-CoV-2抗原单克隆抗体对人鼻拭子、口咽拭子、唾液中的SARS-CoV-2抗原进行定性检测,主要运用于早期感染患者和无症状患者的筛查,整个检测过程仅需2分30秒即可完成。值得一提的是,默禾医疗的新冠抗原检测试剂盒有效检出限相当于核酸检测试剂的33个Ct(Ct值,全名叫Cycle threshold,即循环数阈值,是判断是否感染新冠病毒的依据),作为对照,确诊“金标准”核酸检测的检测阈值是35个Ct。
默禾医疗的新冠抗原检测试剂盒(图片来源:默禾医疗)
2021年1月,默禾医疗的新冠抗原检测试剂盒获得欧盟市场的入场券,即CE认证,此后又获得英国药品和保健产品监管局的认证,截止目前,产品已出口到多个欧盟成员国以及日本、马来西亚等多个国家。
默禾医疗董事长唐荣介绍,为了让产品尽早在国内获得审批上市,《新冠病毒抗原检测应用方案(试行)》发布后,在相关政府部门和园区的支持下,默禾医疗第一时间成立专班组,组织国内申报材料,工作人员们通宵达旦,把原本需花费一年多时间准备的材料压缩在一周内完成了,撰写并补齐了抗原检测产品的体系材料和注册文件136件。
同时,在3月14日国家药监局发布《新冠抗原检测试剂注册技术审评要点(试行)》后,默禾医疗又立即组织团队专门对该审评要点做了逐一学习和对照,根据对照结果分析,默禾医疗的新冠抗原检测试剂盒无论是灵敏度的稀释度指标还是特异性指标,均可达到审评要点规定的的指标参数。
或将开展国内临床试验
在申报材料递交后,国内临床试验也是默禾医疗接下来可能要面临的重要任务,审评要点明确,境外临床试验数据应符合《接受医疗器械境外临床试验数据技术指导原则》和《使用体外诊断试剂境外临床试验数据的注册审查指导原则》的相关要求。同时,提交完整的临床试验方案、报告和伦理审查意见,以及该数据适用于中国患者人群的论证资料、境内外临床试验质量管理差异的对比资料和临床试验质量管理差异,对于临床试验结果影响的论证资料,注册申请人应根据上述临床试验技术审评要求,论证境外临床试验数据的充分性。
“当初产品申报欧盟CE认证的临床试验是在国外做的,可能不能用于国内的申报,公司希望今后在临床试验上得到有关部门和机构的支持,争取尽快完成200例阳性、300例阴性的临床试验。”唐荣表示。
此外,默禾医疗接还将进行试生产,根据国家有关规定,企业要连续生产3个批次的医疗器械产品,随机抽取其中200—300份,送中国食品药品检定研究院进行检测,才能走完注册检流程。唐荣表示:“公司会做好产品试生产,并随时和国家药监相关部门保持沟通,尽快做好检测与审查,争取产品能早日获批上市。”
来源:医谷网
为你推荐
 资讯
资讯 波士顿科学进博会首展首秀4款银发经济相关产品
随着我国老年人口突破3 亿大关,老龄化带来的健康挑战与社会负担日益凸显。在第八届中国国际进口博览会上,波士顿科学本次以技术突破助力构建积极老龄观,为实现健康老龄化提供...
2025-11-05 22:08
 资讯
资讯 杰特贝林与百洋医药强强联合,深度布局中国血液制品黄金赛道
百洋医药将获得杰特贝林旗下人血白蛋白产品安博美®在中国区域内(不包括香港、澳门及台湾地区)特定市场的独家推广、销售和经销权益。
2025-11-04 19:24
 资讯
资讯 新版基本医保药品目录及首版商保创新药目录拟12月第一个周末在广州发布
10月30日-11月3日,国家医保局组织开展2025年国家基本医保药品目录谈判竞价和商保创新药目录价格协商工作,120家内外资企业现场参与,其中参与基本医保药品目录谈判竞价的目录外...
2025-11-04 18:42
 资讯
资讯 健尔圣完成近亿元B轮融资,加速重金属解毒药物研发
本轮融资由广东省江西商会会长、润都制药创始人李希博士领投 8000 万元,著名天使投资人龚虹嘉旗下的嘉道资本追加投资
2025-11-04 15:49
 资讯
资讯 市场监管总局:7起老年人药品、保健品虚假宣传典型案例
2025年,市场监管总局按照深化群众身边不正之风和腐败问题集中整治要求,部署开展老年人药品、保健品虚假宣传专项整治,取得积极成效。现选取一批典型案例予以公布。
2025-11-01 17:32
 资讯
资讯 CDE:老年人群参与创新药临床试验的关键要素及试验设计要点(试行)
本指导原则旨在完全实施ICH E7的前提下,提出老年人群参与的创新药临床试验所涉及的一些关键要素及试验设计中的要点,并未涵盖药物临床试验的全流程或与药物临床试验设计相关的...
2025-11-01 17:09
 资讯
资讯 2026年1月1日,启用新版《药品生产许可证》《放射性药品生产许可证》样式
新版许可证正、副本登载不同的二维码,并分别标注正本二维码和副本二维码字样。正本二维码展示企业基本信息,副本二维码除展示企业基本信息外,同时封装企业车间和生产线、委托...
2025-10-31 17:30
 资讯
资讯 迈科康生物完成超 4 亿元 D 轮融资,核心疫苗研发加速冲刺
本轮融资由 IDG、深创投和瑞普医药联合注资,所募资金将重点投向重组带状疱疹疫苗上市准备、重组呼吸道合胞病毒(RSV)疫苗 III 期临床研究,以及多个创新疫苗管线的临床前研...
2025-10-31 17:15
 资讯
资讯 “全勤生”罗氏:携十余款即将在华上市及未来管线产品首展首秀,加速迈向全疾病领域领航者
第八届中国国际进口博览会(以下简称进博会)进入开幕倒计时,作为最早向商务部表示支持并深度参与进博会的跨国企业,“全勤生”罗氏制药将连续第八年如期赴约。
2025-10-31 15:25