11月28日下午,因“基因编辑婴儿事件”而遭到广泛批判的深圳南方科技大学研究员贺建奎,现身第二届人类基因组编辑国际峰会现场,进行专题演讲并用英语回答现场提问。
作为“基因编辑婴儿”临床试验的主要研究人,贺建奎表示,其将监测基因编辑中的“脱靶效应”,并对两个孩子进行长期的健康跟踪。“公布受试者(基因编辑婴儿)的信息是违反中国法律的,但我建议把试验信息向监管部门公开。”他说,“我们不打算使用任何工具控制他们的未来。我们要让他们自然地生长,要允许他们有选择的自由。”
然而,他并没有给出该试验符合法律规章、伦理法规要求的的有力证据。
贺建奎多次重复,自己会为受试胚胎(受试婴儿)的健康负责,并且如果自己的子女处于类似情况,也会让他们接受这一试验。
两天前,人民网一篇的一条“世界首例免疫艾滋病的基因编辑婴儿在中国诞生”的消息引发了国内外的高度关注。很快,中国科协、中国科学院、各有关学(协)会,学术各界以几乎一致的声音向全球声明:反对基因编辑婴儿事件,认为此事件对中国生命科学领域的国际声誉造成严重损害。“为了维护人类生命的基本尊严,为了维护中国科学界的集体荣誉。”国家卫生计生委医学伦理专家委员会成员、中国医学史专家袁钟教授写下感想。
多位接受健康点采访的专家表示:“不分学科,不分派别,中国学术界从未像今天这么团结过。”健康点独家获悉,中国学术界正在紧急起草关于基因编辑的专家共识,弥补中国在此领域行业指引的空白。健康点还对话卫生技术评估(HTA)、医学史的两位知名专家:复旦大学公共卫生学院、国家卫健委卫生技术评估重点实验室薛迪教授,以及复旦大学附属中山医院院办杨震主任。受访专家从基因编辑婴儿的经济学、伦理学、社会学层面,分析了不可行和不道德之处,以及后续的应对策略。
基因编辑胚胎:风险巨大,不可推广
健康点:从卫生技术评估(HTA)的角度,如何对基因编辑技术用于人体胚胎试验,进行价值评估?
薛迪:涉及到人的卫生技术创新中,当研究风险无法确定或研究风险远大于研究收益时,这项研究不能开展。在收益与风险权衡时,不仅考虑个人与家庭的收益与风险,还需要考虑社会的收益与风险。
一是风险收益比。对接受免疫艾滋病基因编辑的家庭而言,能否避免已完成基因编辑的婴儿感染艾滋病是不确定的,但增加其他疾病感染的机会却是确定的,而且胚胎基因编辑还可能因脱靶突变等原因增加了对婴儿产生其他危害的风险。
与此同时,我们还需要考虑到,现有技术是否已经足以起到预防保健和疾病诊疗的效果?这种现有技术的风险是否远远小于创新技术?除了基因编辑,还有其他成熟方案可以阻断艾滋病的母婴传播。综合来看,基因编辑技术对婴儿及其家庭的收益不确定,对社会也没有技术创新的价值,但人体胚胎细胞基因编辑对人类未来产生影响,如果技术有偏差,还可能会导致出现基因缺陷的后代。基因技术的滥用会给人类带来严重的危害。
二是知情同意。如果“免疫艾滋病基因编辑婴儿”的父母真正理解免疫艾滋病基因编辑对其未出生的孩子意味着什么,有哪些可能的收益与风险;如果他们知道“基因脱靶”带来的巨大风险,如果他们知道还有其他可预防其孩子感染艾滋病病毒的方法,他们还会同意接受这样的尝试吗?(注:贺建奎11月28日公开表示,受试者的家属是具备艾滋病和基因编辑知识的,他们对本次试验的收益风险是可知的。也让他们阅读了21页书面材料。但这一表述未经受试者家属证实。)
三是研究对象的公正性。由于HIV感染者深受感染的困扰,很容易接受研究者所说的可能受益,而忽略研究的可能风险。因此如何保护这些弱势群体免被不当利用,伦理委员会应发挥积极作用。但是,媒体报道显示,在“免疫艾滋病基因编辑婴儿”事件中,未见伦理委员会的作用。
健康点:贺建奎11月28日避而不谈基因编辑婴儿试验是否合法、合规。也有学界和公众给出了不同程度的指控,有的定性为“严重扰乱科研秩序”,有的定性为“伦理法规明确禁止”,甚至有的认为应该以“危害公共安全罪”逮捕贺建奎。应该如何对此临床试验进行定性?
薛迪:我是一名学者,我只能代表个人观点。2016年,原国家卫生计生委颁布的《涉及人的生物医学研究伦理审查办法》规定,医学新技术或者医疗新产品在人体上进行试验研究的活动适用本办法,以及:涉及人的生物医学研究应当符合以下伦理原则:知情同意原则、控制风险原则、免费和补偿原则、保护隐私原则、依法赔偿原则、特殊保护原则。
2003年,科技部、原卫生部颁布的《人胚胎干细胞研究伦理指导原则》规定,禁止利用体外受精、体细胞核移植、单性复制技术或遗传修饰获得的囊胚,不得将获得的已用于研究的人囊胚植入人或任何其它动物的生殖系统。《人类辅助生殖技术和人类精子库伦理原则》中明确人类辅助生殖技术是治疗不育症的一种医疗手段,规定医务人员不得进行各种违法伦理、道德原则的配子和胚胎实验研究及临床工作。
从“免疫艾滋病基因编辑婴儿”事件来看,部分医学研究人员的守法意识淡漠。卫生技术的发展需要符合所在国家的法律法规要求。一个国家的法律法规以国家强制力保证实施,用于约束国家范围内的所有社会成员的行为。但是,基因编辑婴儿试验的当事人更多地从自身利益(如学术名誉)考虑,并没有依法开展医学研究,使受试婴儿和社会承受了的可能风险远大于可能的收益。事实上,我国的法律法规反映的是社会主流的价值取向,作为我国公民必须遵循。
基因编辑婴儿:未成年阶段,需保护隐私等权益
健康点:你如何看待贺建奎课题组与受试胚胎的父母签署的所谓“知情同意书”,及其一系列免责条款?
杨震:全球文明程度高的国家,都有明确法律、法规反对基因编辑人胚胎。从技术进步层面看,确实有一些技术在最开始的时候存在争议。但进入近现代以来,学界和公众出现“一边倒”批判情况,非常少见。这是因为,基因编辑婴儿试验突破了伦理底线。
即便基因编辑试验取得了婴儿家属(《知情同意书》签署人)的完全知情同意,或者《知情同意书》罗列了课题组的免责条款,但这一切不应该违反所在国的法律规章、伦理法规,更不应该替代所在国的法律规章、伦理法规。基因编辑技术不仅涉及签字人(父母)的权利,还涉及到受试者(胚胎、婴儿)的权利。
之前,试管婴儿、器官移植人类面对的伦理风险没有现在这么大。从没有看到受试者受到社会的制约和歧视。基因编辑人胚胎技术运用之后,对人类自身的冲击,是人类社会无法预料的。基因编辑的胚胎,不以自身的意志为转移,就出生了。
如果通过基因检测发现,新生儿确实属于基因编辑婴儿,而且技术不可逆了,受试者的生命权困境就浮现了。父母与课题组签署的免责条款是否具有法律效力,在法律上存在巨大争议。试验人员不能免责条款,就对受试者的人生不管不顾,这是严重违反生物伦理和社会道德原则的。全社会不应该替课题组为这一行为兜底,并为此付出巨大的社会成本,并让受试者面临巨大的健康风险。
健康点:假设基因编辑婴儿被基因检测所证实,这两个孩子,以及长大后的基因编辑人,应当如何被人类社会对待?
杨震:既有的法律和道德都会受到冲击,产生巨大的争议。大家在翻阅浩如烟海的法律条款时,可能会相当失望。现有法律法规都着眼于如何预防此类事项发生,而不是发生之后如何应对。针对基因编辑人,是否需要单独立法,或者出台法律修正案。
我们不能轻易将基因编辑婴儿界定为“类人生物”,必须按照人类来对待,保障其基本人权。下一步要讨论的,如何避免基因编辑人对人类物种的伤害。基因编辑婴儿在未成年之前,按照《未成年人保护法》,不应受到任何伤害。
我不赞成一些偏激观点:
有些人提出,对基因编辑婴儿进行所谓“人道毁灭”,如果没有任何法律法规的依据,谁来执行,谁敢执行,会不会涉嫌故意杀人而违反《刑法》。所谓“人道毁灭”根本不具备合法性。毕竟基因编辑婴儿出生后,不只是处于胚胎阶段,不是靠流产就能解决的。
有另一些人提出,对基因编辑婴儿,一出生就将其与其他人类隔离。我也是反对的。要不要因为一起伤天害理的事情,为了弥补它,去做出更多伤天害理的事情?是否符合法律法规、公序良俗,是我们要遵循的基本原则。
当政府被迫拖入基因编辑人的危机应对中,政府不能让基因编辑人处于失访状态,但也不应该在未成年阶段就暴露基因编辑人的身份。
在具有生育能力之后,基因编辑人也要肩负一定的责任,虽然他们的出生不以他们的意志为转移,但他们将终生背负道德责任,乃至是道德枷锁,与其他人类可能不一样。究竟是需要他们自己约束自己,还是法律对他们进行约束。其他人类为避免基因编辑人污染基因池,可能会对他们的生育权造成损害。
健康点:包括贺建奎在内的一些“出格”技术的实验者为自己辩解说,自己的工作只是为了追求人类更美好。在漫长的中外医学史上,总有一派激进的医学工作者、科学工作者认为,现有人类物种并不是进化的终点,热衷于研究“超人类”。你怎么看?
杨震:面对牵涉人类的根本利益和生物体重大改变时,我们只能予以重大关注,且趋于保守态度。假如有人想说,我想长四只手、六条腿,我们究竟要不要同意?人类自然繁衍是可以接受的,但外来干预之后,人类是否继续存在,本身就是一个问号。
人类并不一定就要飞到天上去,或者直接潜到海里去——这不是人类的必需品或者义务。如果人类面临灭绝的危机,我们才需要选择一种风险很大的人类的物种改造技术。但显然,现在人类还没有面临这样的巨大危机。
科学肯定受到时代的制约,我们跳不出自己所处的时代。我们只能在这个时代已有的研究成果,如何保险地为人类负责。研究者不能以“真理掌握在少数人手中”为由进行辩解——我们决不能拿全人类的命运赌博。我们在没有任何证据时,就只能选择保守。
来源:健康点healthpoint
作者:梁嘉琳
医谷链
《贺建奎“基因编辑婴儿数据”首次公开(附其现场演讲完整57页PPT)》
来源: 健康点healthpoint 作者:梁嘉琳
为你推荐
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
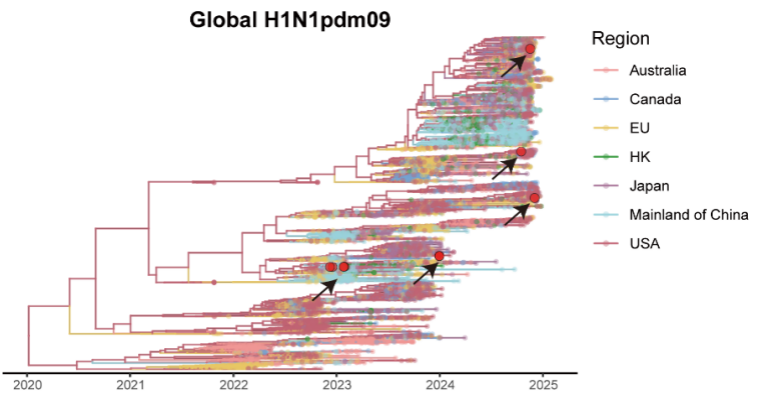
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22
 资讯
资讯 箕星药业宣布成功完成D1轮2.87亿美元融资,推进口服GLP-1药物开发
1月22日消息,箕星药业有限公司(Corxel Pharmaceuticals Limited)宣布已成功完成D1轮融资,募集资金高达2 87亿美元。
2026-01-23 18:00
 资讯
资讯 基因启明完成亿元天使轮融资,加码iNKT细胞疗法研发与临床转化
本轮融资由人合资本独家投资。融资资金将重点用于推进公司核心iNKT细胞药物的临床试验进程,同时加速新管线的研发拓展与技术平台升级。
2026-01-23 14:05
 资讯
资讯 商务部、国家发改委、国家卫健委、国家医保局等9部门印发促进药品零售行业高质量发展的意见
鼓励符合监管要求的实体医疗机构、互联网医院与药品零售企业依托电子处方流转平台进行处方流转。鼓励建设非医保药品自费处方电子流转平台,规范和完善相关药学服务。
2026-01-23 11:04
 资讯
资讯 诺和诺德聚焦零售药店体重管理服务,启动“零售科学减重生态联盟”
1月22日,诺和诺德在福州举办超越·共盈——诺和诺德零售生态伙伴大会,大会汇聚连锁零售药店管理层、临床专家、资深药师、行业智库、零售生态合作伙伴等多方力量,正式启动零...
2026-01-22 21:53
 资讯
资讯 优赫得在华获批治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者
基于DESTINY-Gastric04 III期试验结果,与雷莫西尤单抗+紫杉醇相比,优赫得®可为患者带来具有显著统计学差异和临床意义的总生存期(OS)改善,两年OS率实现翻倍
2026-01-22 17:53
 资讯
资讯 传奇生物CAR-T细胞药物 Carvykti(西达基奥仑赛)2025年销售额18.87 亿美元,同比增长 95.9%
强生2025年全年收入达到941 93亿美元,同比增长6%,净利润268 04亿美元,同比增长90 6%,调整后净利润262 15亿美元,同比增长8 1%。
2026-01-22 16:48
 资讯
资讯 从收费难题到医保立项:机器人诊疗迎来普及拐点
2025年12月5日,国家医保局向各省医保局下发了《手术和治疗辅助操作类医疗服务价格项目立项指南(征求意见稿)》,用于在医保体系内部征求意见。
文/梁瑜 2026-01-21 16:48
 资讯
资讯 英矽智能6600万美元授权一款具有穿透血脑屏障的潜在在研抗炎药物
1月20日,英矽智能发布公告称,与深圳衡泰生物科技有限公司就 ISM8969 项目达成共同开发合作协议。
2026-01-21 15:42
 资讯
资讯 国家医保局规范手术和治疗辅助操作类医疗服务价格,手术机器人有了系统明确收费指引
近日,国家医保局编制印发《手术和治疗辅助操作类医疗服务价格项目立项指南(试行)》,将已有价格项目规范整合为37项,覆盖医学3D重建、生物3D打印、术中显微成像、手术路径导...
2026-01-21 15:12








