2021 年 11 月 7 日,上海 — 今日,武田制药举办“双星熠动 武拓新生”肺癌专场发布会,被誉为“肺癌双星“的两款肺癌治疗新药 Mobocertinib 和布格替尼(Brigatinib)首度亮相进博,拉开了武田制药进军中国肺癌治疗领域的序幕,为肺癌领域罕见靶点阳性的患者带来新的希望。同日,武田制药宣布与五家业内知名的基因检测公司共同成立“武田肺癌诊疗联盟”,旨在整合在诊断和治疗领域的优势资源,在肺癌生物标志物检测领域展开合作,共同提升患者及医生的精准诊疗理念,帮助患者获得全方位诊疗一体化的解决方案,促进中国肺癌精准诊疗的发展。
嘉宾共同见证武田“肺癌双星”首次亮相
肺癌位居中国恶性肿瘤发病率首位[1],是中国癌症防治所面临的重大挑战之一。近年来,得益于医学技术的快速发展,肺癌患者的生存情况已得到极大的改善。但现有治疗方案对于部分患者的临床治疗存在局限,一些罕见靶点阳性及难治型患者的生存现状仍不乐观,亟需更有效的解决方案。在本届进博会上,武田携两款肺癌治疗领域的全球创新产品首度亮相,正式宣布将在中国进军肺癌领域。两款产品针对性地为肺癌领域的一些罕见靶点提供了创新的治疗方案,将有望满足这些患者严重的未满足需求。
以 EGFR 20 号外显子插入突变为例,此类患者仅占非小细胞肺癌患者总数的 2.3%[2],而目前在国内缺乏针对这一靶点突变的靶向治疗方案,致使这些患者仍在维持效益有限的传统治疗,其预后相比携带其他 EGFR 突变基因的患者相去甚远。为满足这些患者的实际临床需求,由武田引进的用于治疗 EGFR 20 号外显子插入突变非小细胞肺癌的 Mobocertinib已在中国正式获得国家药品监督管理局药品审评中心受理,并获准纳入优先审评审批程序,将有望成为国内首个获批上市的针对 EGFR 20 号外显子插入突变阳性患者治疗的口服药物。Mobocertinib 由中国参与全球研发,已获得中美两国的‘突破性疗法认定’,并已于 2021年 9 月获得美国 FDA 批准上市。
另一类 ALK 融合阳性患者则常常面临脑转移的问题,初诊时发生脑转移的患者接近30%,而在治疗过程中颅内进展占比高达 70%[3],严重影响患者的生活质量和长期生存。自今年 8 月以来,武田第二代高选择性酪氨酸激酶抑制剂(TKI)布格替尼已通过“先行先试”政策在博鳌乐城加速实现获批应用,让中国患者不出国门就能享有国际先进的创新药物。布格替尼旨在用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。该产品在治疗 ALK 阳性晚期非小细胞肺癌患者的效果显著,在中国具有临床急需性。
周彩存教授介绍中国肺癌诊疗现状
中国临床肿瘤学会(CSCO)非小细胞肺癌专家委员会主任委员、同济大学附属上海市肺科医院肿瘤科主任周彩存教授表示:“作为一名肺癌治疗领域的医务专业工作者,我很高兴能够看到越来越多创新的治疗方案能够在各方支持下,第一时间加速引进中国,为肺癌罕见靶点患者带来新的希望,并助力中国肺癌诊疗水平与国际接轨,推动行业发展。“
在加速引进创新产品的同时,武田也积极致力推动肺癌精准诊疗的应用普及。为进一步推动肺癌精准诊疗理念,提升肺癌领域罕见难治靶点的诊断率,在本次肺癌专场发布会中,武田宣布将联合燃石医学,艾德生物,至本医疗,世和基因,华大基因等五家行业主流检测公司签订合作框架协议,共同成立武田肺癌诊疗联盟,普及精准诊疗理念,更好地帮助患者从“精准医学”中获益,助力中国肺癌诊疗技术与国际接轨。
武田肺癌诊疗联盟成立仪式
“很荣幸能够通过第四届进博会的平台分享全球创新经验与成果,展现武田在探索肺癌等核心领域的道路上长期深耕结晶,促进健康行业发展。”武田制药全球高级副总裁,武田中国总裁单国洪先生表示:“肿瘤领域是武田在全球的核心治疗领域之一,武田在肿瘤领域积累了丰富的行业经验和创新实力,并致力于通过创新的癌症治疗方案,满足癌症患者群体的未尽需求。秉承‘以患者为先’的理念,武田将持续加速创新药物的开发与引进,并通过多方合作共同提升中国癌症诊疗水平,为改善人民健康水平、助力‘健康中国 2030’目标的实施贡献力量。“
参考文献:
[ 1 ]:https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
[2]Liu ZF, et al. Clinical characterization of ERBB2 exon 20 insertions and heterogeneity of outcomes responding to afatinib in Chinese lung cancer patients. Onco Targets Ther. 2018;11:7323-7331
[3] Costa DB, et al. Clinical Experience With Crizotinib in Patients With Advanced ALK-Rearranged Non-Small-Cell Lung Cancer and Brain Metastases. J Clin Oncol. 2015;33(17):1881-1888
为你推荐
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
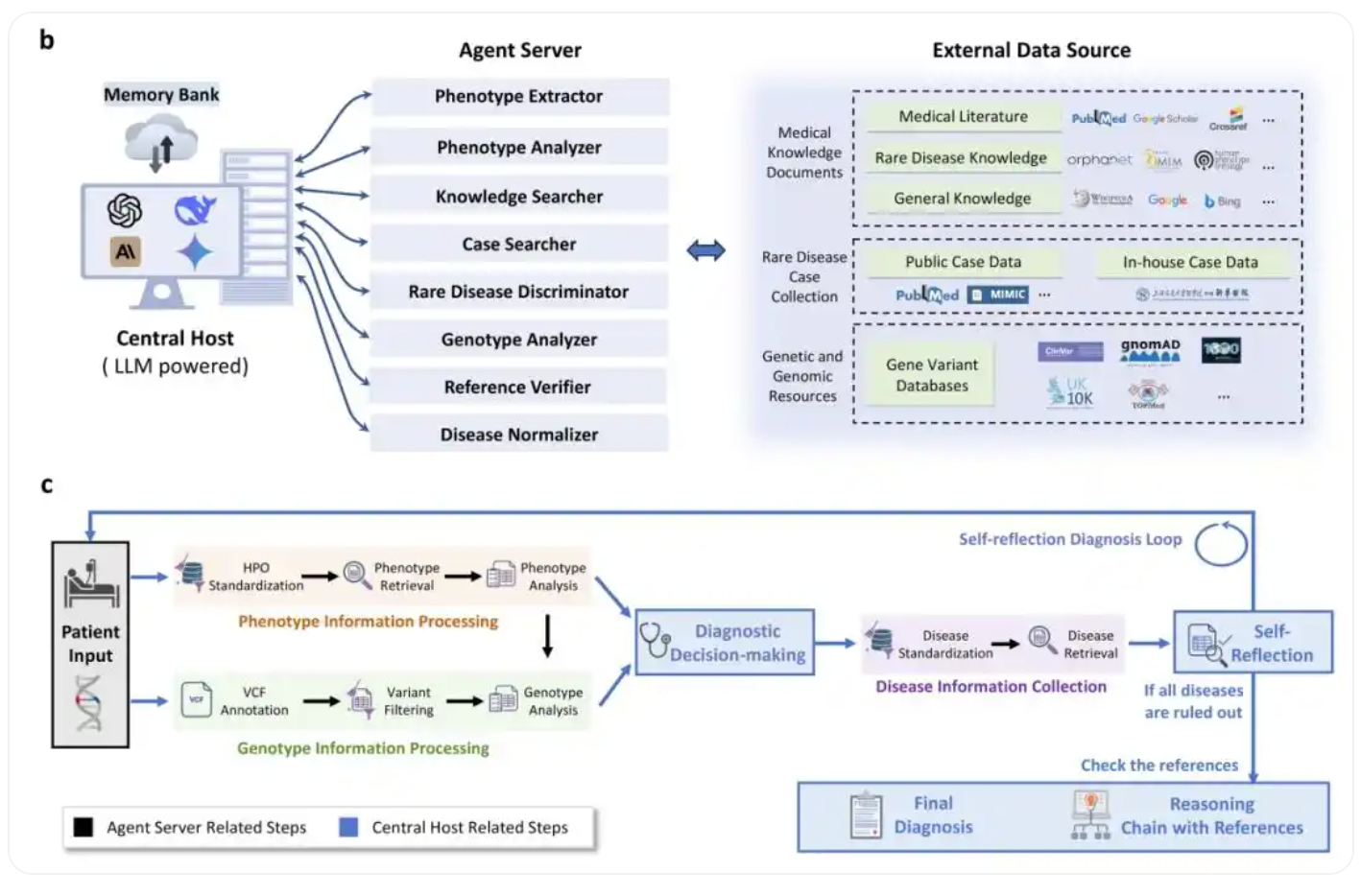
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42
 资讯
资讯 礼来ACHIEVE-3完整数据公布:orforglipron在头对头研究中优于口服司美格鲁肽
2026年2月26日,礼来正式公布了ACHIEVE-3研究的完整数据。该研究结果同步发表于国际权威医学期刊《柳叶刀》。
2026-02-27 11:38
 资讯
资讯 诺和诺德大幅下调司美格鲁肽价格
近日,诺和诺德宣布,将将大幅下调美国的司美格鲁肽药物官方标价(批发采购成本)其中减重版司美格鲁肽Wegovy降幅度50%,降糖版Ozempic降幅约35%。
2026-02-26 13:37
 资讯
资讯 新版《鼓励进口服务目录》发布,生命健康领域有哪些?
2月25日,商务部等七部门联合发布新版《鼓励进口服务目录》,目录主要包含研发设计服务、节能环保服务、环境服务、咨询服务、其他专业服务和医疗与健康服务六大板块。
2026-02-26 11:29
 资讯
资讯 长春高新一项拟用于改善特发性原因导致儿童小阴茎的临床试验获批
2月24日晚间,长春高新(000661 SZ) 发布公告称,旗下核心子公司金赛药业自主研发的GenSci141软膏(双氢睾酮软膏) 正式获得国家药监局临床试验批准通知书。
2026-02-25 22:32