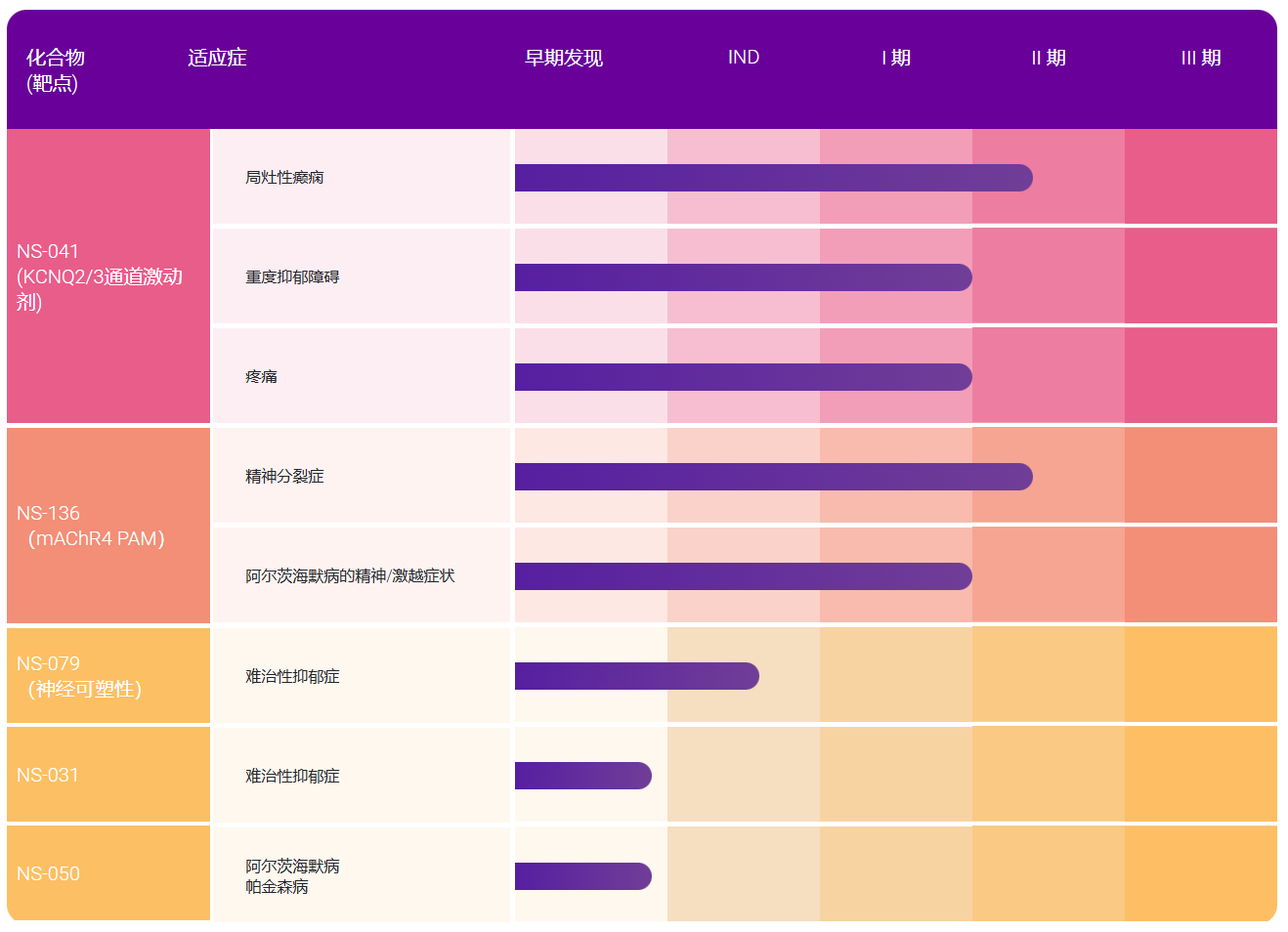
潜规则1:拿别人家的机器去注册,自己同步研发
众所周知的,医疗器械产品的注册周期很漫长,要经过产品开发——第三方检测——临床应用——体系审核——行政审批。也就是说一个机器辛辛苦苦走完了整个过程的时候,还不知道用户会不会买呢,由此来看,制造商投资风险之大可想而知。
于是一个办法就产生了,制造商先买一个别人家的同类机器,把外壳换掉就去注册检验和临床了,更有甚者,连壳都不动,撕下面膜,擦掉厂家标识,换上自己做的面膜,堂而皇之的注册去了。即使检测机构有怀疑,一是事不关己高高挂起,再者现在委托加工方式也不少,多事的话也许冤枉了好人。另外,能检某类产品的检测机构也不是独家,找一个不容易出事的地方检测不就结了。比如买一台东北厂家的机器,在广州的检测所去检。
检测的过程中,企业在做什么呢?他们在开发自己的产品,用别人家的孩子骗来出生证的时候,自家的孩子也该出生了,这时候作个注册变更,报几份材料,换个照片,补充说明下连个产品只是外观有些局部差异,其实内部设计思路是一样的云云,反正讲起里面的电路和机械的原理绝对是厂家的强项,于是就巧妙的规避了注册流程的繁琐过程,抢回了宝贵的进入市场的时间。
有人会说,那有啥,机器人家不也做出来了吗?我要提醒的是:真正卖的机器的审批过程肯定是有漏洞的,你看得是别人家孩子的信息,哪知道真正的孩子可能有残疾。现在监管机构有所认识了,OEM方式正在被禁止,但也只是堵住了一个说辞的漏洞,胆大的老板们照样买别人的机器来注册。
潜规则2:临床的无奈,不是机器的问题,而是医院的沟通和协调问题
现在的三类医疗器械,注册时都要求通过临床应用验证,这本无可厚非,枪炮不经过弹药的洗礼怎么证明自己的效用呢。可问题是,全国指定的医院就那么有限的几十家,像深圳也就一家而已,还好多设备的临床不能做,没个省平均有限的几家不到。
于是厂商为了做临床,就得找院方临床科室的主任,找医工办、找伦理委员会,真正的临床花在行政上的时间、精力和费用(注意不是官方费用)让企业不堪其扰,如果花了钱,提供了机器和材料,临床就有人给安排了也行,做不到的,关系没打点好,临床上机器给你放在一边不理不睬,十天半月、一年半载、三年五年都是可能的。
现在为了保护患者,加了患者知情同意书,没有患者同意使用临床验证设备的书面签字,设备还不能用。一是患者很难同意,二是由此引申出每个病例要付多少费的事情。这也认了。还有个麻烦就是医院内部协调,挺大个机构,又是不对等的关系,临床科室的负责人、具体使用设备的医生、医工处、伦理委员会、设备科,他们相互之间的扯皮和人事矛盾的潜规则,都可能引起企业临床的麻烦。企业也无奈。
潜规则3:第三方检测机构的刁难
产品临床前必须经过第三方检测机构关于安规和性能的检测,本也无可厚非,但是检测人员的不作为,在那一拖了之,一个说词就是忙啊,于是企业为了加快,就塞红包,拉人泡歌厅,甚至奉上小姐肉弹,假设一下,如果没有了吃拿卡要的现象,单凭个人欲望的发泄,中国的地下色情业估计比美国的华尔街好不了。吃拿卡要也算带动了消费,再分配了社会财富,也算是个黑色的灿烂吧。我认识的朋友1年多了机器还没开始检,而有的却几乎是企业想哪天检就能哪天检,为什么呢?不言自明。
人家第三方检测机构也有管理的,比如有的规定,送检的机器必须60个工作日内处理好。OK,没问题,第58个工作日的时候,给你发个传真或发个邮件,都不打电话,为的是留个自己的证据,证明自己没超标。“你的产品说明书有点问题,你改一下”,也许只是个很小的问题,但等你改完了再提交的时候,那是另一个60个工作日开始了,于是乎,一个小问题=60个工作日,慢慢就耗死你。
潜规则4:设计更改,机器和标准对不上
国家有规定,机器作了设计更改,要求作重新检测、注册变更,大的改变重新作临床,这个也没问题。问题是现在的竞争态势是不理性的,张家医院招标要求A指标突出,李家医院要求B指标特点,谁家的机器能全具备这些东西,为了做成生意,销售就做三点工作:
一是贿赂拿下招标负责人,把标书就按我家的产品来写,别人家自然歇菜,美其名曰“技术壁垒”;
二是设计更改,谎称能对上符合标准,以假充真,我敢断言,现在去对企业做审查,拿标准和产品本身去对比,当今国内,能有50%能对得上的,我敢把脑袋拧下来让您当球踢,因为我很有把握,还因为这个数值可能高达70%、80%,我留足了余量。
三是故意在设计时把指标弄得很高,检测时对对付付的通过,实际应用上就不让客户用这个指标,客户都很懂行,一般也不敢用,这样投标就没问题了,质量控制体系中检测作业指导书上,边缘极限指标干脆就不检或数据造假应付认证审核机构。
潜规则5:审批部门的工作流程拖沓冗长,没关系不塞钱就是个拖
然后是药监部门的行政审批,没几个月走不完流程,药监部门的成立,大概就是来阻碍企业发展的,理由也很充分,“又不是你们一家企业,不得排着队一个个来啊”,是阿,有关系的、花钱的、腐败的就能提前,老实本分作企业练内功的,你就耗着吧。我曾经有个大胆的设想,如果哪一天颠倒了,药监系统的审批干部去企业里负责注册,不知道会不会换位思考?企业里的注册经理去药监审核,不知道会不会小人得志便猖獗?
最要命的是他们永远没错,一旦临近了,同检测机构一样,随便挑你材料点问题,就可以往回打,有一个新的轮回就开始了,让你欲哭无泪,欲笑无声。我理解国际贸易中有两个壁垒,一个是行政壁垒,一个是技术壁垒,但一般都是卡外国人,保护民族工业的,现在的药监行政壁垒,大概弄反了,大型外企的高层直通上头,反而快,受压抑的却是民族产业。
潜规则6:投标机型投标前临时拼凑
曾经和军方、国家行政采购审批部门的官员坐聊,他们认为采购的机器怎么着也得是企业的基本成熟产品吧,即使改动也很小。这里透露一点小秘密,投标机型大都用于配发或战略储备物资,所以企业不必担心投诉,储备的一般不会用,配发的是白给的,白吃枣还嫌有虫的人不多的。
经济的发展给了国家和平的资本,也给这些人提供了无良的温床,一旦备战救灾,My God,英雄没死在战场上和抢险现场上,却可能死在病床上。还不会有人知道,因为他们已经受伤了,死亡也许不可避免,另外,死亡的责任如果不归于患者,就会在医生和设备之间打架,医生不懂设备,设备不懂医学,医生也很懂这场纷争的风险,于是联合推给患者了之最方便。反正你又不设备又不懂医学,怎么和两大专业的利益集团斗。
配发机器的问题就更不用说了,本来就不是我急需的东西,硬送给我,用不用都不着急,我曾经遇到很多配发一年了还没装机的医疗设备。但真装机的时候,发现问题一堆,也过了保修期,你就掏钱挨宰吧。
潜规则7:重审批,轻监管
西方国家的政府,是小政府大社会,对行业的监管通过技术标准、检查机构,政府去监管检查机构和标准制定组织。监管机构为了吃好不用发愁四处找市场的饭,就不得不绞尽脑汁的想办法替政府把好关。审批方面过关之后,监管机构就具备了随机抽查产品和管理体系的资格。这把无形的达摩里斯利剑时刻悬在企业的头上,威慑力重了许多。
国内的监管明显弱了许多,偶尔也会搞个行业的抽检,但限于很多条件,被抽检的厂家和产品很少,被抽检几乎成了小概率事件。更有甚者,个别的时候,被抽检到的产品有了问题,有背景的厂家一公关,不合格事件都不会公开了。最后就成了蒋经国当年的上海之行,尽打苍蝇不打老虎。我就曾经见识过某年的国家行业抽检,几大厂商都有点问题,最后罕见的统一到了一起,联合攻关,硬是将各自的问题压下了没公开。政府严格管理的目的是最后把有实力的企业浮出来成为支柱,绝不是攻关有实力的企业。产品的实力是由技术人员创造的,公关的实力是由营销人员创造的。
潜规则8:CE/FDA宣传的机器基本没有卖入欧盟国家和美洲大陆的
漫步医疗器械展会,满眼是企业拉出的横幅,“国内第一家通过CE认证的**产品”“国内第一家通过FDA认证的产品”,于是用户就信以为真了,以为这产品真得厉害。我们公开一下,绝大多数企业的产品,宣传归宣传,看一看有几个真正销往了欧洲大陆和美洲大陆,欧美只对进入本土的外来器械进行严格监管,只要没进来,审批时过就过了,宣传就宣传了,倒可以唬唬非洲中东的兄弟们,反正他们也没有欧美的严格审查,有证书就认的。
也有把产品卖到欧盟和美洲大陆的,但那是转口地,是由欧美的中间商再销往其他地区。敢把产品卖入欧美的产品才是真的通过了CE/FDA,作为用户,不妨问一问,设备商曾经将产品卖入了美国哪个州哪家医院。
潜规则9:医生拿回扣,投标走形式
目前的药品虚高,大家都知道啥原因了,器械也一样。没有回扣的销售偶尔也许发生过,但因为是利益共同体,查起来也难。但愿有良知的作设计的弟兄们,也有和我一样的,写些文章出来,把各机型的成本晒一晒,让大家知道虚高在哪里了。投标的现场基本是做秀,曾经历过我们的答辩人在会场上临时收到短信调整价格的,原因是讲解产品的卖点时候与对手的重叠了,不调整价格拿不下单子,谁传出来的消息呢?傻子都知道。
内奸不除,能紧守城堡吗?可如果人人是内奸,还除谁呢?组织招标的人就是最核心的内奸,他选择专家的时候就专选有倾向性的,即使中立的也会被提前洗脑,不同意下次不请你了,断你份收入来源。
潜规则10:行业学协会充当皮条客,劳务费中介费变身广告费
行业协会、各类学会的主任委员、活跃分子都是被企业竞相献宠的对象,这是一个通过技术影响决策的群体,活跃其中的专家们充当的是皮条客的角色,促进立项,介绍评委,技术说客。他们的报酬大都是项目合作资金、讲课的课时费,或者给学会办的杂志付广告费。虽然这个群体没有最后的决定权,但他们是架通官商之间的桥梁。
利用国有机构的看好办起了杂志,利用退休官员聘任的方式打入了官场,利用专家参与和学协会的平台为商人当起了打手。不过这一点并不必太在意,毕竟人家只是为了自己的一点蝇头小利,蝇营狗苟而已,他们并没有拿不合格的产品害人,还是靠付出劳动换取经济回报的劳动者。
医疗设备行业的潜规则还有很多,都无所谓,世皆熙熙,皆为利来,世皆攘攘,皆为利往,大家要生存,也是迫不得已,在不伤害民众的基础上的利益获取,也可以理解。但唯愿能通过大家的努力,让大家了解医疗设备从业人员的辛酸与无奈,更多一分同情;也将可能为害我们健康乃至性命的设备、厂家、管理制度遏制住,让我们放心的去用国产的医疗设备来。
(以上设备未指全部医疗设备,有一些细分的产品领域已经做得较好,十大潜规则中会有部分不适用,特此说明。)
来源:医路通
为你推荐
 资讯
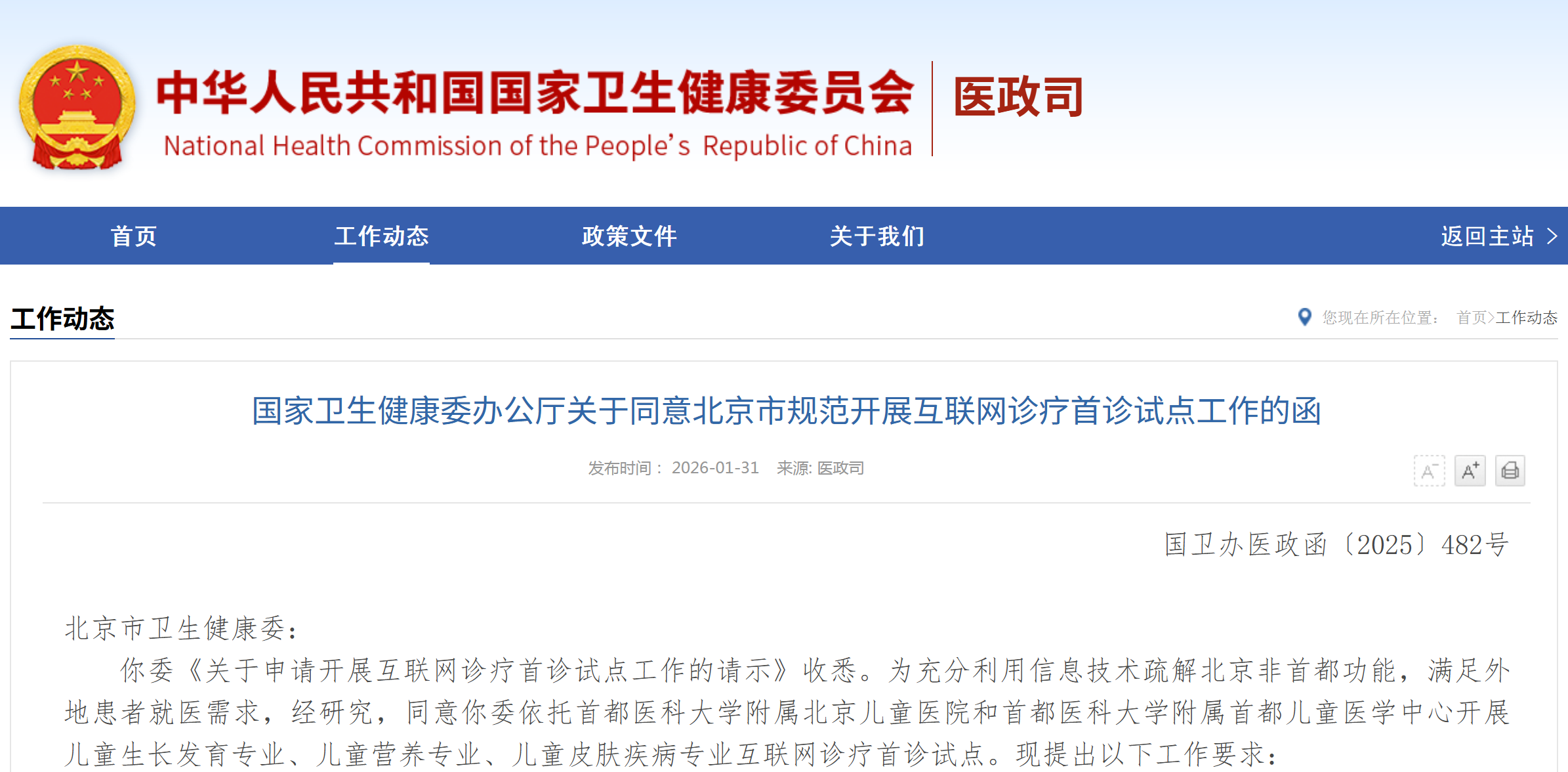
资讯 儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业纳入北京互联网诊疗首诊试点
经研究,同意你委依托首都医科大学附属北京儿童医院和首都医科大学附属首都儿童医学中心开展儿童生长发育专业、儿童营养专业、儿童皮肤疾病专业互联网诊疗首诊试点。
2026-01-31 23:34
 资讯
资讯 诺和诺德大中国区换帅:周霞萍3月底离任,“老兵”蔡琰接棒
1月30日,全球制药巨头诺和诺德正式对外宣布重大人事变动,其全球高级副总裁兼大中国区总裁周霞萍决定离开公司,最后工作日为2026年3月31日
2026-01-31 17:36
 资讯
资讯 思璞锐SciBrunch完成超3500万美元Pre-A轮融资,一年内两轮合计募资6500万美元
本次Pre-A轮融资由生物医药领域知名投资机构弘晖基金(HLC)领投,InnoPinnacle Fund跟投,同时获得老股东汉康资本、博远资本、LongRiver江远投资及骊宸投资的持续加码支持。
2026-01-31 17:30
 资讯
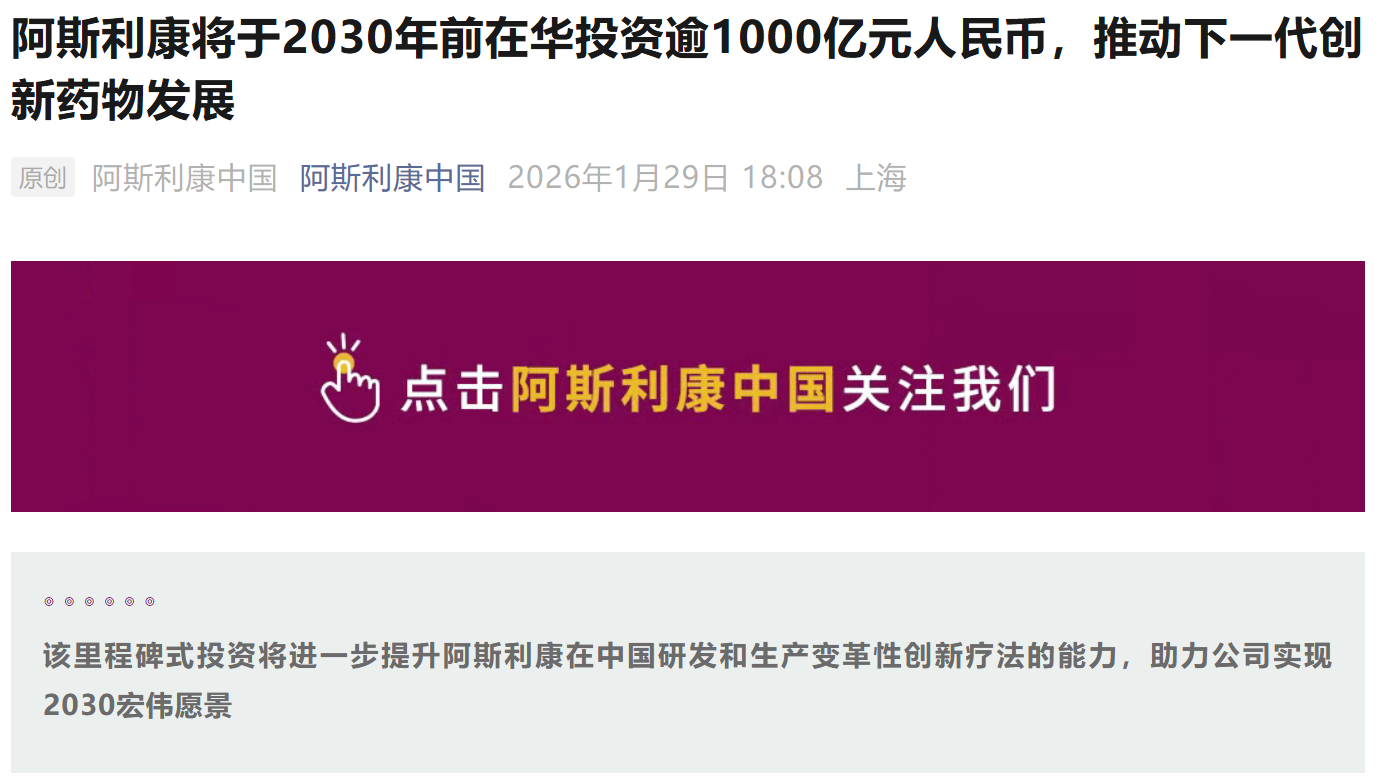
资讯 阿斯利康宣布将于2030年前在华投资逾1000亿元人民币,与石药集团达成超百亿美元战略合作
1月29日,阿斯利康宣布,计划于2030年前在中国投资逾1000亿元人民币(150亿美元),以扩大在药品生产与研发领域的布局。公司将充分发挥中国的科研优势和先进制造能力,并依托中...
2026-01-30 13:00
 资讯
资讯 从“无差别轰炸”到“定点爆破”,我国二线HER2阳性胃癌治疗迎来靶向ADC新突破
近日,优赫得®(注射用德曲妥珠单抗)正式获得中国国家药品监督管理局(NMPA)批准,单药用于治疗既往接受过一种含曲妥珠单抗治疗方案的局部晚期或转移性HER2阳性成人胃或胃食...
2026-01-29 18:54
 资讯
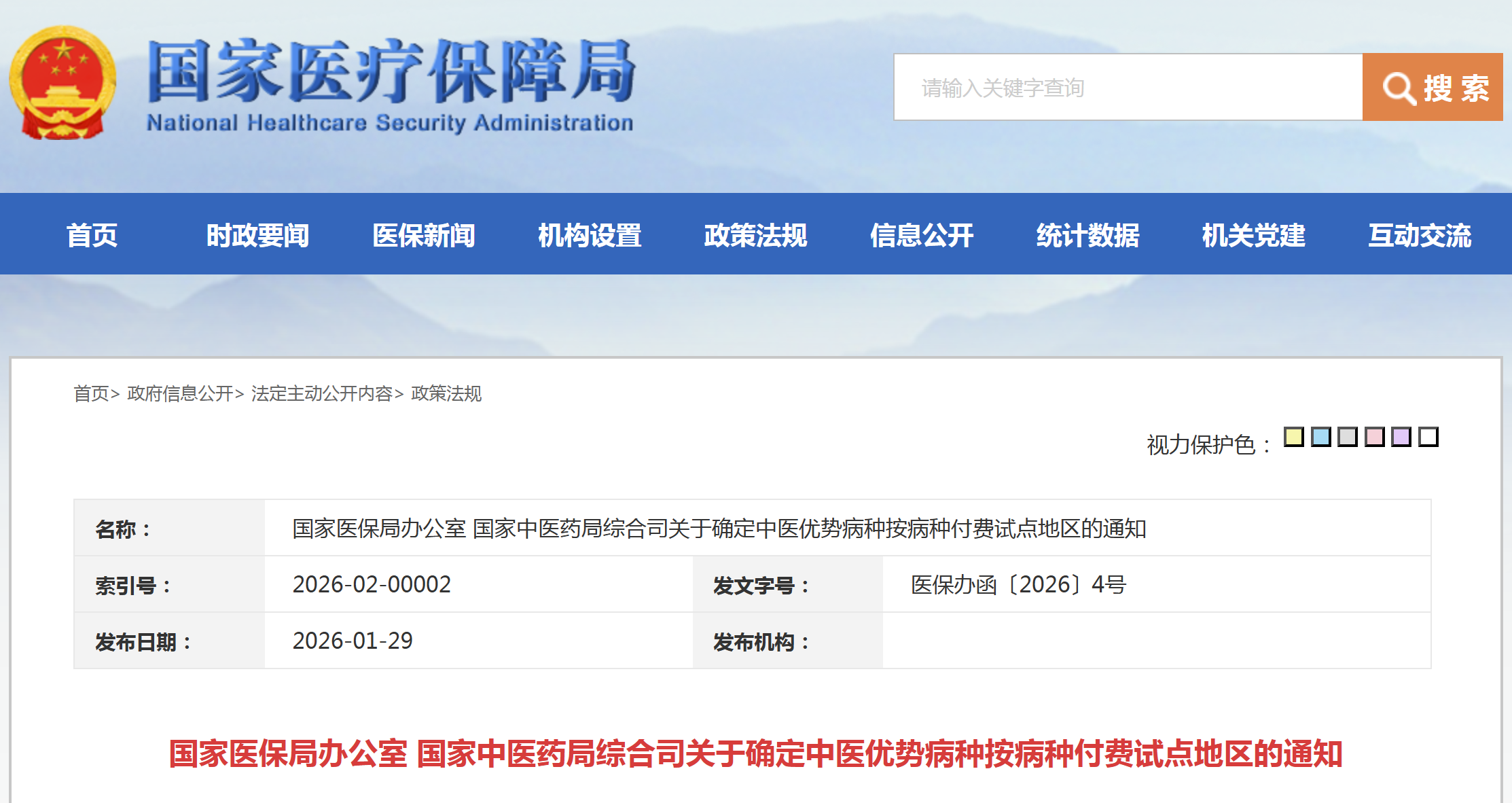
资讯 18个区域,中医优势病种按病种付费试点地区明确
根据《关于开展中医优势病种按病种付费试点工作的通知》要求,国家医保局、国家中医药局组织专家对申报中医优势病种按病种付费试点的地区开展遴选,经相应程序,确定北京、河北...
2026-01-29 18:16
 资讯
资讯 合成生物创新企业康诺生物递交港交所上市申请
康诺生物核心业务聚焦于线粒体功能障碍相关疾病的研究,专注于NAD+抗心血管疾病、NAD+抗生殖功能障碍、NAD+抗神经退行性疾病和NAD+抗衰老等领域的科学应用
2026-01-29 18:15
 资讯
资讯 奥纳再生完成数千万天使轮融资,加速异种移植技术产业化落地
本轮融资由达安创谷领投,黎曼猜想担任独家财务顾问,所筹资金将主要用于核心技术平台建设、现有产品管线研发推进及IND申报工作,助力公司加速异种移植技术的产业化落地,破解全...
2026-01-29 18:00
 资讯
资讯 施维雅集团2024-2025财年合并销售收入达69亿欧元,同比增长16.2%,美国市场表现卓著
1月27日,全球知名跨国药企施维雅集团正式公布了2024-2025财年的财务业绩。施维雅集团2024-2025财年的合并收入达69亿欧元,超额完成60亿欧元的目标。较上一财年增长16 2%,显现...
2026-01-28 17:20
 资讯
资讯 时隔23年,新修订的《中华人民共和国药品管理法实施条例》全文
1月27日,《中华人民共和国药品管理法实施条例》正式对外发布,这是时隔23年以来,首次全面修订药品管理法实施条例。
2026-01-28 12:38
 资讯
资讯 先声药业一款双抗在研药物10.58亿欧元授权勃林格殷格翰
1月26日,先声药业发布公告称,与勃林格殷格翰达成一项许可与合作协议,双方将共同开发先声药业的临床前阶段TL1A IL23p19双特异性抗体SIM0709,用于炎症性肠病(IBD)的治疗。
2026-01-27 17:55
 资讯
资讯 国家卫健委:新型抗肿瘤药物临床应用指导原则(2025年版)
新型抗肿瘤药物的一个显著特征是出现一批针对分子异常特征的药物——即分子靶向药物。 目前,根据是否需要做靶点检测,可以将常用小分子靶向药物、大分子单抗类药物以及小分子...
2026-01-27 11:46
 资讯
资讯 CDE:针对泛肿瘤的抗肿瘤药物临床研发技术指导原则
泛肿瘤是从肿瘤起源和病因学等角度,将多种组织来源的肿瘤视为同一类疾病,并且寻求相同的治疗手段。当针对共有的分子改变开发药物时,不同肿瘤的患者均有可能从相同的药物治疗...
2026-01-25 18:54
 资讯
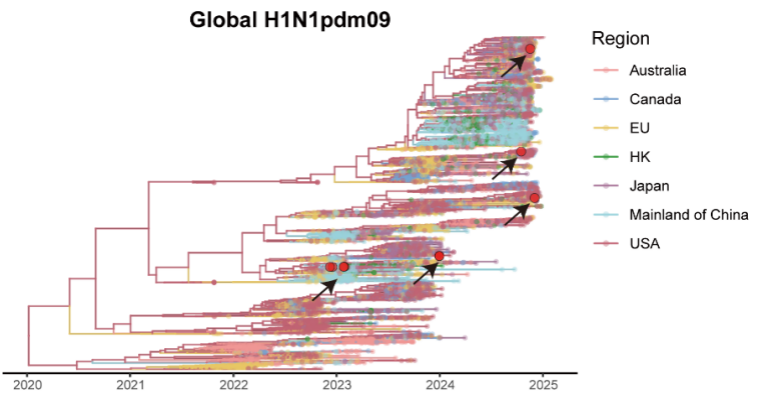
资讯 病毒“突变”不等于更强生存力——华山张文宏教授团队发现:敏感性下降,往往伴随适应性下降
玛巴洛沙韦敏感性降低的突变发生率仍然极低(0 05%),未发现典型的I38T耐药突变。
2026-01-24 12:22