我们认为就试点区域目前的实施效果来看,提高了2017年全面落的确定性,本文重点研究分析分级诊疗落地对于检验科产业链的影响。
检验量+检验质量,两方面看分级诊疗对检验科的影响。分诊疗对检 验科的直接影响就是不同级别医院检验量的变化,同时基层检验需求的 提高对检验结果提出了高要求,我们从量和质量两方面来看:
检验量向基层迁移,三级医院检验结构变化。多个疾病基层首诊后将直接提高基层检验量,当诊疗意识转变后,更多病人将不分病种的在基层首诊,将首诊检验量由三级向一二级医院迁移;三级医院首诊量下降,转诊量上升,整体维持在稳定水平,同时由于疾病类型由普通病症向疑难病症改变,对特检的需求显著高于普检,检验类别可能由以普检为主向特检为主转变。
转诊需求增加,区域检验互认将成发展趋势,基层检验水平要求提 高。由于上下转诊等流程,问诊次数增加,区域检验结果互认有望 大范围落实,以降低重复检验次数,进一步降低费用,与之相对应 的,互认范围内的医院所使用的产品在品质上有较高要求。
2010年卫计委就发布了关于推进同级医疗机构检查结果互认工作的通 知,目前第一例检验结果互认于2016年10月落实到京津翼地区131家医疗机构(三级医院+医检所),对27项临床检验结果实施互认,虽然中短期结果互认仍只会在同级医疗机构实施,但是基于分级诊疗和避免重复过量检验的需求,我们认为区域检验结果互认未来有望扩展到区域内各级医疗机构,包括三级以下医院和区域检验中心。
分级诊疗落地,将对检验科上下游各环节的竞争格局带来重大变化检验科作为诊断的终端使用者,我们对其产业链进行分析:
1、上游是诊断产品的生产企业,包括试剂和仪器生产;
2、中游是产品流通渠道,由于诊断产品品类繁多,大多厂家九成以上产品采用经销模式销售,代理商主要负责医院等渠道开发、产品物流和售后以及其他提高客户粘性的 增值服务,由于直接对接终端,因此流通渠道在诊断行业非常重要,对上游的议价权较强;
3、下游就是包括检验科、第三方医检所在内的诊断产品使用者,当前由于POCT产品的快速发展,一部分品种将直接应用于消费者(患者)。
产业链产值分配:上游430亿,中游956亿,下游1471亿。根据2015版中国卫生和计划生育统计年鉴和赛柏蓝器械的数据统计,2014年医院总收入16611.73亿元,我们假设三级医院检验科占比7.5%、二级医院10%和一级医院12%、年增长率6%计算出2015年终端诊断市场为1471亿元,产品进医院价格按照平均六五折计算,则中游渠道市场为956亿元,产品出厂价按照渠道价格的四五折计算,则上游市场为430亿元。
上游强调性价比,中游重新洗牌,下游倾向第三方。
分级诊疗出台落地时间点恰好伴随着新医改的深入,政策间的相互影响将对检验科整体产业链产生极大影响:
1、上游生产企业在质量和成本控制上有高要求(基 于区域结果互认和医院检验科盈利诉求对上游产品价格施压);
2、中游流通企业将由传统经销逐渐向综合服务倾斜,当前多且分散的代理商由 于掌握了大部分终端资源,在耗材两票制、终端检查降价等影响下可能 逐渐被生产、流通服务、第三方检测企业整合,未来集中度会进一步提高;
3、下游受分级诊疗影响较大,一二级医院检测能力的匮乏导致对区 域检验中心的需求提高,三级医院处于成本端的控制,也会提高对第三方检测服务的需求。
检验结果互认+基层价格敏感性,性价比是关键
检验结果互认和国内充分竞争品类仍集中在传统生化免疫,量值溯源重 要性凸显。量值溯源是指通过不间断的链条,使检验结果与国家或国际 标准一致,更通俗一些就是指不同设备试剂在同个检测项目上检测结果 一致。
从京津翼结果互认上来看,试点的项目基本集中在生化、半定量免疫上,而从 IVD 细分领域来看,这类产品的国产化率最高,发展相对 成熟,我们认为未来其他区域检验结果互认也将首先从成熟品种开始。 这类仪器大多是半开放式,多数项目试剂厂家多且分散,检验结果溯源性差,要满足三级医院的检验要求,质量控制非常重要。
目前对产品来说,比较常见的量值溯源标准包括ISO 17511、ISO 15183,针对医学实验室还有ISO 15189、室间质量评价 RELA 等实验室认证。一般规模 化大型生产企业(尤其是以诊断产品为主业的上市公司)均很重视产品量值溯源,随着国家药监局和地方药监局对医疗器械企业质量监管的加 强,我们认为传统生产领域不规范的企业将逐渐被淘汰,集中度进一步 提高,对于二级市场来说,利好生产型诊断上市公司市场份额的提高。
产品质量差异性不大时,我们认为可以通过市场占有率来评价品牌影响 力和渠道能力。传统产品在大型企业间的质量差异相对较小,这种情况 产品品牌力和渠道力非常重要,我们建议采用市场占有率来作为衡量指 标。以 2015 年年报数据为准,根据我们的测算 2015 年出厂口径大约在430 亿元,由于国内企业大多同时代理进口品牌,为避免进口产品的重 复计算,我们仅计算国内上市公司份额,进口品牌其他代理商口径计入 其他项,可以看到国产企业在市占率上平均在 1-3%之间,科华生物作 为老牌的上市公司在品牌影响力和渠道上都有较大的优势。
EM+在华设立生产工厂,外企生产端向国内转移,价格可能随成本降 低而下降。2016 年是国际诊断巨头们在华合作或设厂最多的一年,为了 应对终端持续性的检验降价以及分级诊疗带来基层检验需求上升,外企 不得不重视价格对销量的影响,无论是在国内设厂还是找国内厂家代工, 主要目的都是为了降低生产和运输成本,一旦工厂投产或代工产品上量, 将从价格上对国内厂家带来很大压力,尤其在终端收费不按进口国产区 分后(根据国家关于城市公立医院综合改革试点的指导意见中所述,未 来有望采用按病种/服务单元作为定价标准),国产产品为保持价格优势 可能会采取进一步降价的措施,利润空间可能被压缩,成本控制能力强 的企业有望获得更高的盈利能力。
原料与诊断试剂性价比直接相关。(1)原料基本决定产品毛利率和降价空间。国内诊断产品生产企业的销售模式多以设备投放,试剂销售为主,试剂是收入和利润的主要构成,因此我们只讨论试剂毛利率。影响试剂毛利率的因素主要是原料供应和出厂价,出厂价基本是按照终端价格的五折甚至更低来定,因此自产原料的占比和品种基本决定了产品毛利率水平;(2)原料批间差和稳定性决定产品质量。诊断试剂的保质期通常在3-6个月,为了保证检验结果的一致性,产品的批间差和稳定性是衡量产品质量的重要指标,在生产工艺不变的情况下,原料的批间差和稳 定性就决定了制剂质量。
企业试剂毛利率水平间接反映原料自产能力。为了满足量值溯源要求,企业必须保证使用的试剂原料满足质量要求,在研发和自产能力有限时只能采取外购方式(大多数高品质原料需进口),而原料占成本60%,外购越多毛利率可能越高。我们选取了传统诊断生产企业试剂毛利率进行对比,平均毛利率在60%-80%之间(相同结构企业受出厂价影响较小,安图、新产业等以化学发光为主的试剂毛利率平均水平在80%-90%左右),其中九强生物毛利率最高,接近80%,我们认为可以从中间接判断相关企业的原料自产能力。
原料种类繁多,高品质原料研发难度大。原料生产可分为综合性原 料供应商规模化生产和诊断产品企业自产原料两种方式,从全球范围来说,原料供应商少见综合大型原料企业,品种最全规模最大的仍属罗氏,国内规模最大是菲鹏生物,其品种完善程度仅次于罗氏,其他成规模的更多是专注某一领域的原料供应商,根据草根调研,我们发现单项目高品质原料在全球基本是寡头垄断,比如芬兰HyTest就是全球最大的心肌标志物原料供应商。由于诊断产品种类 繁多,原料多样复杂,研发投入并不会少于一个新项目,综合型原 料企业易做到大而全,但是许多高质量需求的品种(比如抗体抗原 等)仍然难与进口品种相比,而出于对成本的控制和摆脱供应商的 依赖,生产企业有动力进行原料研发,尤其是同时进行新项目和相 关原料的研发,两者可以有效协同。因此我们认为生产型企业自产 原料相较综合原料供应商,更符合发展趋势,有针对性的进行原料 研发比“大而全”更具性价比,目前已经有原料储备和原料研发能力的企业将最终受益。
研发能力决定能否产出强竞争力的产品
特色项目向存量替代和增量市场两方向发展。区别于完全竞争的生化和 传统酶免,此处我们说的特色项目多为高技术壁垒,或发展阶段处于早 期的产品:1、进口替代/技术换代。这类产品虽然技术壁垒高,但是国 内市场上有可替代品种或有成熟商业化的进口品种,对产品质量性能要 求高(具代表性的是化学发光、微流控芯片等);2、新项目/新方法学。多数处于市场推广期,国内竞争者少或者竞争优势显著,除了研发能力 还需要具备较强的市场推广能力。
化学发光未来三年受益于渠道下沉和传统方法学替代,潜在市场30亿。区别于市场上大部分的观点,我们认为目前国内化学发光产品 的质量水平距离进口产品仍有较大差距,除了个别项目(传染病、TORCH 等)可以进入三级以上医院,大多集中在二级医院,中短 期进口替代的逻辑较难成立,我们更看好其在分级诊疗落地后及终 端普遍降价下的渠道持续性下沉和对传统酶免等方法学的替代。
POCT满足基层医疗机构对快速、小型化设备的需求,国内定性、 半定量产品已成熟,定量产品仍处于早期阶段。国内应用最广泛的 主要是胶体金、免疫层析等定性和半定量免疫方法,且集中在心血 管领域,这是由于心血管领域对于检测的时效性要求高于准确性,我们预计未来5年心血管类产品仍将维持 25-30%的复合增速,是POCT 中增速最快的细分领域。
与此同时,国内近几年不断涌现多种定量POCT方法学,包括热景生物的上转发光、金准生物的量子点荧光以及微点生物的免疫微流控芯片,在目前半定量的基础上进一步提高检测的准确性,达到完全定量水平,随着产品稳定性提高,市场推广顺利,此类新方法学有望迅速上量。以微点生物为例,免疫微流控芯片系列mlabs上市仅三年,就占公司总收入的八成以上。
来源:乐晴智库
为你推荐
 资讯
资讯 上海医药iNKT细胞注射液获批临床试验
1月20日,上海医药集团股份有限公司发布公告称,下属上海医药集团生物治疗技术有限公司自主研发的“B023细胞注射液”收到国家药品监督管理局核准签发的《药物临床试验批准通知书...
2026-01-20 16:49
 资讯
资讯 蚂蚁阿福升级PC端,面向医生群体上线 DeepSearch功能
今日,蚂蚁阿福升级其 PC 端,并上线DeepSearch(深度搜索)功能打造中国版“Open Evidence”,免费为医生、医学生及基层医疗工作者等泛医学人士提供专业服务。蚂蚁阿福 PC...
2026-01-20 15:56
 资讯
资讯 可突破血脑屏障,FDA受理非小细胞肺癌创新药上市申请
近日,美国生物医药公司Nuvalent宣布,美国FDA已受理其为zidesamtinib递交的新药申请(NDA)
2026-01-20 11:41
 资讯
资讯 核药创新再破局!远大医药TLX591-CDx国内NDA获受理
远大医药(0512 HK)再度传来核药重大利好——公司用于诊断前列腺癌的创新放射性核素偶联药物(RDC)TLX591-CDx向国家药监局递交的新药上市申请(NDA)已获受理。
2026-01-19 21:29
 资讯
资讯 eCTD验证软件更新V1.1.0版,3月1日起,V1.0版及配套操作手册将不再适用
本次更新内容主要包括新增原料药申请验证规则,调整PDF文件书签、超链接和文件大小验证规则、完善部分文字描述等。
2026-01-19 14:18
 资讯
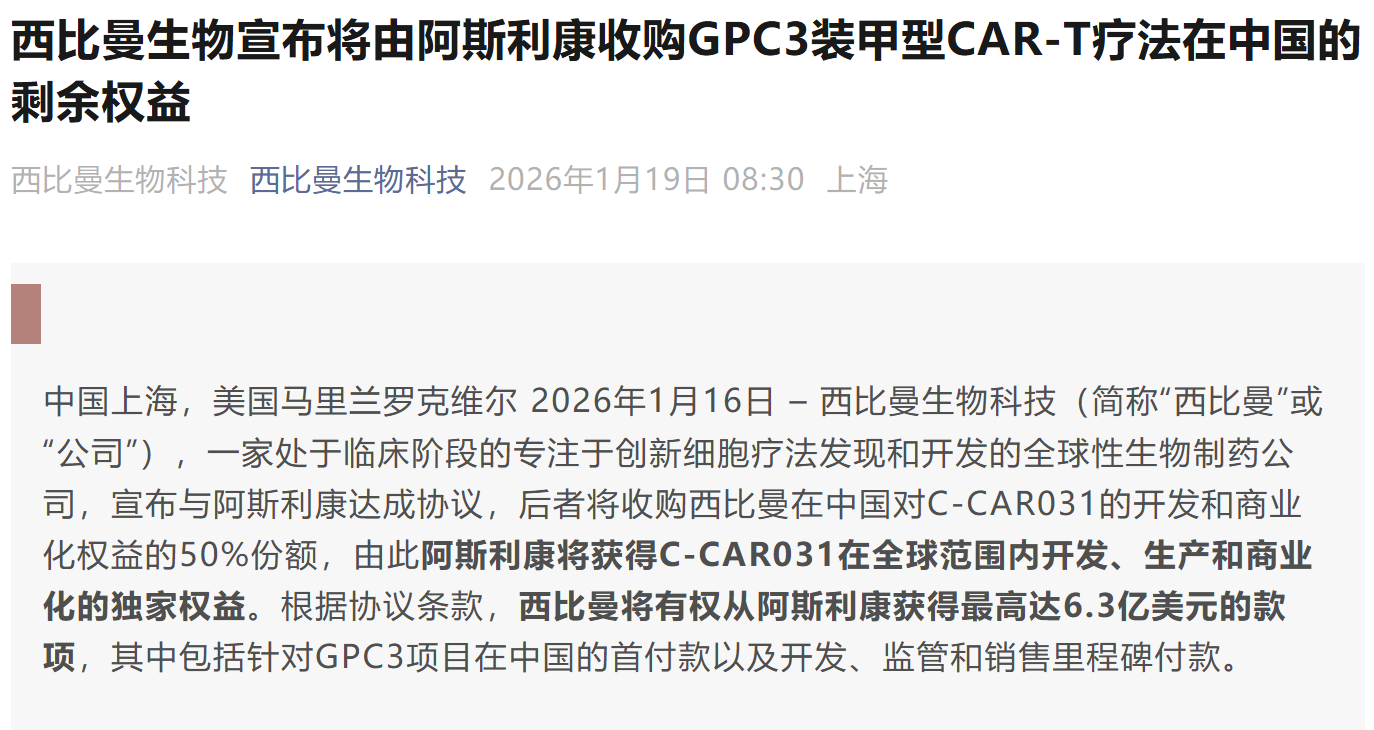
资讯 阿斯利康获得西比曼靶向GPC3细胞疗法剩余50%的全球权益
1月16日,西比曼生物科技宣布与阿斯利康达成协议,后者将收购西比曼在中国对C-CAR031的开发和商业化权益的50%份额,由此阿斯利康将获得C-CAR031在全球范围内开发、生产和商业化...
2026-01-19 13:19
 资讯
资讯 2025年国民经济数据:16—59岁人口85136万人,占全国人口的比重为60.6%;60岁及以上人口32338万人,占全国人口的23.0%
全年出生人口792万人,人口出生率为5 63‰;死亡人口1131万人,人口死亡率为8 04‰;人口自然增长率为-2 41‰。
2026-01-19 11:41
 资讯
资讯 2026年1月14日起,均适用《Q8、Q9和Q10问答(R5)》国际人用药品注册技术协调会指导原则
自2026年1月14日起开始的相关研究,均适用《Q8、Q9和Q10问答(R5)》。
2026-01-19 11:24
 资讯
资讯 糖尿病治疗1类创新药奥洛格列净胶囊获批
1月16日,国家药监局官网信息显示,近日,国家药品监督管理局批准宜昌东阳光长江药业股份有限公司申报的1类创新药奥洛格列净胶囊(商品名:东泽安)上市,该药适用于改善成人2型...
2026-01-17 23:20
 资讯
资讯 CDE:中药复方制剂新药研发人用经验收集整理技术指导原则(试行)
人用经验是“三结合”中药注册审评证据体系的重要环节。如何产生可评价的人用经验、怎样收集整理人用经验数据,对于筛选确定临床有效处方、合理利用人用经验支持后续研发及决策...
2026-01-16 21:09
 资讯
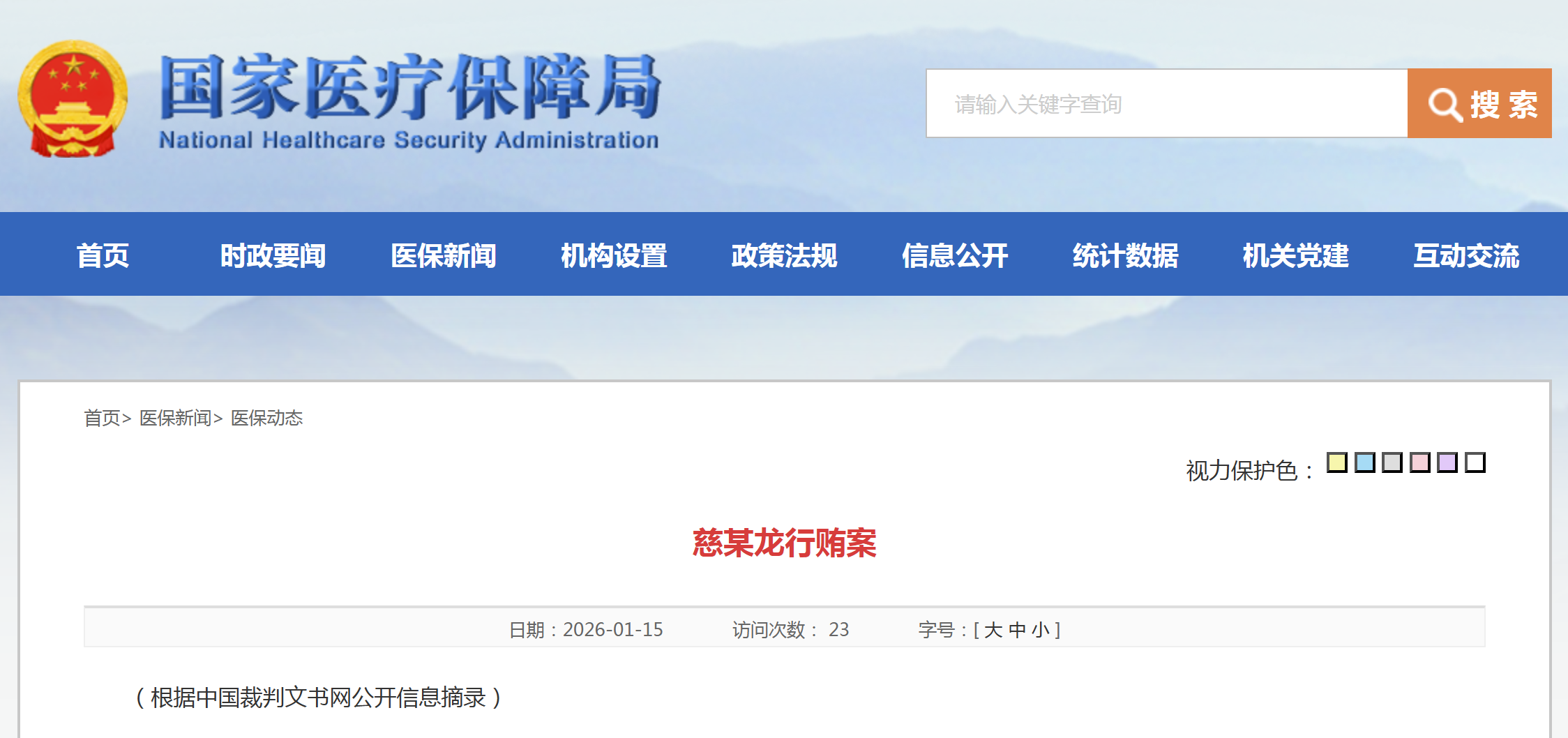
资讯 国家医保局再发布两起行贿案例
继发布《医药咨询服务企业涉商业贿赂案》和《党某海犯非国家工作人员受贿罪案》后,国家医保局再次发布《慈某龙行贿案》和《重庆康荣医疗设备有限公司涉商业贿赂案》。
2026-01-15 11:49
 资讯
资讯 阿斯利康收购AI制药公司Modella AI
美东时间,本周二,阿斯利康在摩根大通医疗保健大会上宣布,已收购总部位于波士顿的Modella AI,这是首次有大型制药公司全面吸收一家专业人工智能公司。
2026-01-14 17:21
 资讯
资讯 甘李药业甘精胰岛素获欧盟上市许可,将于赛诺菲同台竞争
1月14日,甘李药业盘后发布公告,甘李药业股份有限公司及其欧洲全资子公司甘李药业欧洲有限责任公司(Gan & Lee Pharmaceuticals Europe GmbH,以下简称“甘李欧洲”)于近...
2026-01-14 16:52
 资讯
资讯 第六批国家高值医用耗材集采药物涂层球囊类、泌尿介入类中选结果公示
1月14日,国家组织高值医用耗材联合采购办公室发布国家组织药物涂层球囊类、泌尿介入类医用耗材集中带量采购中选结果公示,即第六批国家高值医用耗材集采。
2026-01-14 14:44






















