2020年1月21日,赫赛莱(通用名:恩美曲妥珠单抗)在中国获批上市,成为中国乳腺癌领域首个上市的抗体偶联药物(ADC),为更多乳腺癌患者带来治愈希望。为更好地满足乳腺癌患者的治疗需求,进一步减轻患者经济负担,近日罗氏宣布降低恩美曲妥珠单抗的价格,降幅高达52%,为乳腺癌患者带来福音!
恩美曲妥珠单抗,不断探索乳腺癌患者治愈和生存之路
2020年全球癌症数据显示,乳腺癌已经超过肺癌成为发病率最高的癌种。每年新发病例约230万,占所有肿瘤的11.7%1。HER2阳性乳腺癌约占全部乳腺癌的20%~25%,是预后较差的乳腺癌亚型,严重影响患者的身心健康。目前早期乳腺癌的治疗以治愈为目标,特别是自1998年曲妥珠单抗上市以来,HER2阳性早期乳腺癌患者正走在治愈和康复的道路上,且随着抗HER2治疗领域的蓬勃发展,HER2阳性乳腺癌已成为乳腺癌领域内治愈率最高、靶向药趋于全面、诊疗手段更为成熟的疾病亚型。
新辅助治疗是早期乳腺癌实现治愈的关键步骤。天津肿瘤医院张瑾教授介绍道:“通过新辅助治疗,不仅可以使乳腺癌降期以利于手术,或变不能手术为能手术,满足患者保乳意愿,提升患者远期预后,还可为术后辅助治疗提供体内药敏信息,以指导辅助治疗方案的选择。”目前,乳腺癌新辅助治疗已获得国内外权威指南的一致认可与推荐,并在临床实践中得到广泛应用。尽管抗HER2新辅助治疗显著提升乳腺癌患者的病理学完全缓解(pCR)率,但仍有约30%-60%患者存在残存病灶(non-pCR)。与达到pCR患者相比,non-pCR的HER2阳性患者复发和死亡风险更高,五年复发和死亡风险较pCR患者高2.6倍,亟需新的药物来打破这一局面。
值得欣喜的是,2020年初恩美曲妥珠单抗在中国上市,被中国国家药品监督管理局(NMPA)批准用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,填补了这部分患者的治疗空白,为这部分高危复发风险的患者带来全面治愈生机。
恩美曲妥珠单抗不仅为早期高危复发风险患者带来治愈希望,其在晚期乳腺癌中的探索也从未止步。对于HER2阳性晚期乳腺癌患者,抗HER2治疗仍然是治疗的基石。赫帕双靶是目前HER2阳性晚期乳腺癌的一线标准治疗方案,尽管使患者的生存期大大延长,但是几乎所有的患者最终都会出现疾病进展。对于这部分患者,临床亟需疗效更优、耐受性良好的二线治疗方案。
凭借在抗HER2治疗耐药患者中的独特优势,2021年6月22日,恩美曲妥珠单抗再次获得NMPA批准,用于单药治疗接受了紫杉烷类和曲妥珠单抗治疗的HER2阳性、不可切除局部晚期或转移性乳腺癌患者,为这部分患者提供强有力的治疗选择,让更多中国HER2阳性晚期乳腺癌患者从中获益,实现长期生存。
用医学证据说话,为临床诊疗提供坚强后盾
早期乳腺癌
对于药品的疗效和有效性,天津肿瘤医院张瑾教授同样也向我们介绍对于赫赛莱早期乳腺癌相关的内容,KATHERINE研究2,3显示恩美曲妥珠单抗组患者辅助治疗后3年内,无侵袭性癌生存率(iDFS)达到88.3%,曲妥珠单抗单药组为77%,两组绝对差异11.3%(HR:0.5, 95% CI:0.39-0.64, P<0.001),且使患者的复发或死亡风险下降50%。在安全性方面,恩美曲妥珠单抗总体耐受性良好,安全可控。
2019年ESMO ASIA会议公布了KATHERINE研究中国人群数据4,结果显示在中国新辅助治疗non-pCR的HER2阳性乳腺癌患者中使用恩美曲妥珠单抗强化辅助治疗,3年iDFS绝对获益达到13.4%(83.8%和70.4%,HR 0.57;95%CI 0.25 ~ 1.31),降低死亡或复发风险43%,治疗的安全性与国际数据类似。
目前,CSCO、CBCS、NCCN、St.Gallen、ESMO、AGO等国内外指南均一致推荐,恩美曲妥珠单抗作为抗HER2新辅助治疗后non-pCR乳腺癌患者辅助治疗的标准方案。
晚期乳腺癌
EMILIA研究5是一项随机、国际多中心、开放标签的Ⅲ期临床试验,对比了恩美曲妥珠单抗与拉帕替尼+卡培他滨用于既往接受曲妥珠单抗联合紫杉醇治疗的HER2阳性局部晚期乳腺癌或转移性乳腺癌患者的疗效和安全性。结果显示,与拉帕替尼+卡培他滨相比,恩美曲妥珠单抗显著改善了患者的中位无进展生存期(mPFS,9.6个月 vs. 6.4个月, HR=0.650,P<0.001)、中位总生存期(mOS,30.9个月 vs. 25.1个月,HR=0.682,P=0.0006)、客观缓解率(ORR,43.6% vs. 30.8%,P<0.001)和中位缓解持续时间(mDOR,12.6个月 vs. 6.5个月),死亡风险显著降低32%。
2021年ESMO更新的EMILIA研究亚洲人群数据显示恩美曲妥珠单抗较拉帕替尼+卡培他滨OS获益更加显著(34.3个月 vs. 22.7个月,P=0.0034 ),降低57.2%亚洲人群死亡风险。
基于EMILIA研究结果,恩美曲妥珠单抗已成为国内外权威指南一致建议的HER2阳性晚期乳腺癌二线标准治疗药物,也是国内二线治疗唯一ADC药物。
ADC药物,为抗肿瘤而生的“生物魔法导弹”
知其然,亦要知其所以然。针对ADC药物,天津肿瘤医院张瑾教授也向我们介绍道,恩美曲妥珠单抗之所以能在早期和晚期HER2阳性乳腺癌领域取得如此卓越的疗效和可控的安全性,主要得益于其独特的作用机制。恩美曲妥珠单抗是全球首个获批单药治疗实体瘤的ADC药物,也是中国首个HER2靶向ADC药物。
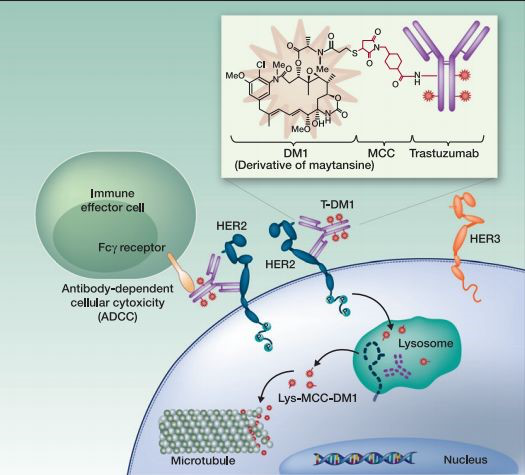
恩美曲妥珠单抗由单克隆抗体曲妥珠单抗、非还原性硫醚接头和微管蛋白抑制剂美坦辛衍生物(DM1)组成,具有曲妥珠单抗大分子抗体依赖性细胞介导的细胞毒性作用(ADCC)和DM1的双重作用机制,借助曲妥珠单抗的靶向性,将高效杀伤的DM1带至HER2阳性肿瘤细胞内部并释放DM1,以达到精准杀伤肿瘤的目标。
值得一提的是,DM1的细胞毒作用为普通化疗的24-270及上千倍,并且有报道称微管蛋白抑制剂的抗肿瘤效应相比拓扑异构酶Ⅰ抑制剂强10-100倍。不仅如此,其独特内吞机制可有效克服下游PI3K通路活化,同时增加肿瘤微环境中的CD8+T细胞比例,与免疫治疗联合使用具有协同增效作用。
图1 恩美曲妥珠单抗作用机制
成本与效益并重:恩美曲妥珠单抗直接降价52%,提升药物可及性,满足患者需求
在疾病的治疗过程中,有无对应获批的适应证、是否有充足的临床数据和指南推荐是最为主要的考量因素,然而,经济因素也是长期治疗过程中不可忽视的一方面。尽管恩美曲妥珠单抗可为HER2阳性乳腺癌患者带来治愈和长期生存的希望,但很多乳腺癌患者因经济负担重而没有机会接受恩美曲妥珠单抗治疗。为减轻患者及家庭负担,早在恩美曲妥珠单抗上市后国内就已同步开启了患者援助项目。
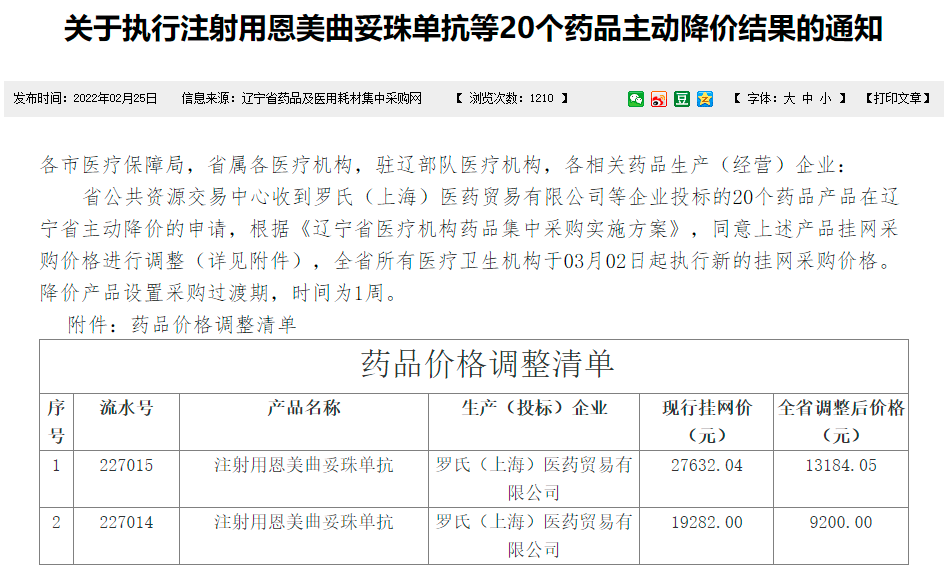
本着惠及更多患者的宗旨,罗氏顺应国家对于癌症用药的关注,决定直接降低恩美曲妥珠单抗的挂网价格,进一步减轻患者的经济负担,本次降价高达52%;100mg/瓶剂型由19282.00元降至9200元,160mg/瓶剂型由27632.04元降至13184.05 元。针对上述的降价,天津肿瘤医院张瑾教授也表示非常欣喜的能够看到药品价格的直接下调能够使得更多乳腺癌患者惠及新药、好药,提高药物的可及性和可支付性。3月份各省级将陆续发布最新恩美曲妥珠单抗挂网价格。相信随着恩美曲妥珠单抗主动降价52%,临床医生和患者都将备受鼓舞。此次降价将大大降低患者经济负担,提高药物可及性,更好地满足乳腺癌患者的用药需求。
图2 恩美曲妥珠单抗降价通知(辽宁省)
期待进入医保,惠及更多乳腺癌患者
随着国家持续扩大医疗保障的覆盖,越来越多的“救命药”进入医保,进一步缓解和减轻民众用药难和用药贵问题。天津肿瘤医院张瑾教授也表示非常期待恩美曲妥珠单抗早日进入国家医保目录,进一步降低患者自付比例,提高药物可及性和可支付性,让更多乳腺癌患者获得治愈机会,助力实现“健康中国2030”的宏伟蓝图。
参考文献:
1. Sung H, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
2. Von Minckwitz, et al.Phase III KATHERINE Clinical Trial Crossed Early Reporting Boundaryand Met its Primary Endpoint.SABCS 2018. Abstract GS1-10.
3. von Minckwitz G, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 Feb 14;380(7):617-628.
4. Chiun-Sheng Huang, et al. Trastuzumab emtansine (T-DM1) vs trastuzumab (H) in Chinese patients (pts) with residual invasive disease after neoadjuvant chemotherapy for HER2-positive breast cancer (BC) in the phase III KATHERINE study. ESMO Asia Congress 2019.
5. Dieras V, et al. Trastuzumab emtansine versus Capecitabine plus lapatinib in patients with previously treated Her2 Positive Advanced Breast Cancer (Emilia) : A descriptive aspect Analysis of final overall survival results from a randomised, open Phase 3 trial.Lancet Oncol, 2017, 18 (6) : 732⁃742.
来源:医脉通
为你推荐
 资讯
资讯 中国制药装备行业协会副秘书长遆倩鹤涉嫌严重违法,正接受监察调查
2月6日,中央纪委国家监委网站讯 据中央纪委国家监委驻中央社会工作部纪检监察组、海南省纪委监委消息:中国制药装备行业协会副秘书长遆倩鹤涉嫌严重违法,目前正接受中央纪委...
2026-02-07 22:13
 资讯
资讯 CDE:化学仿制药透皮和局部给药系统黏附性和刺激性/致敏性评估临床试验技术指导原则(试行)
本指导原则适用于TDS化学仿制药。常见适用TDS包括可能描述或称为贴片、透皮贴剂或缓释膜固态制剂产品。应用本指导原则时,请同时参考药物临床试验质量管理规范(GCP)国际人用药...
2026-02-07 13:48
 资讯
资讯 诺华可善挺(司库奇尤单抗)放射学阴性中轴型脊柱关节炎(nr-axSpA)新适应症在华获批
适用于治疗对非甾体类抗炎药(NSAID)应答不佳的活动性放射学阴性中轴型脊柱关节炎成人患者(其客观征象表现为C反应蛋白(CRP)升高和 或磁共振成像(MRI)证据)
2026-02-06 15:54
 资讯
资讯 天津市互联网诊疗监管实施办法(试行)
医疗机构应当主动与市级监管平台对接,及时上传、更新《医疗机构执业许可证》等相关执业信息,主动接受监督。医疗机构取得《医疗机构执业许可证》后或《医疗机构执业许可证》变...
2026-02-06 08:59
 资讯
资讯 八部委发布《中药工业高质量发展实施方案(2026—2030年)》
培育60个高标准中药原料生产基地。协同体系更加健全,中药材种植加工、中药研发生产、流通服务等上下游各环节协同更加紧密,建设5个中药工业守正创新中心,推动一批中药创新药获...
2026-02-05 21:21
 资讯
资讯 国家医保局今年将重点对精神类定点医疗机构开展专项飞检
各省级医保部门要组织本辖区内所有精神类定点医疗机构从即日起全面开展自查自纠,重点聚焦但不限于诱导住院、虚假住院、虚构病情、虚构诊疗、伪造文书、违规收费等违法违规使用...
2026-02-05 17:13
 资讯
资讯 国际SOS荣膺“2026年度全球杰出雇主”
今日,国际SOS宣布,公司连续第八年荣获杰出雇主调研机构(Top Employers Institute)授予的杰出雇主认证。
2026-02-05 14:42
 资讯
资讯 默克高管周虹离任,诺和诺德官宣在即,医药行业再迎关键人事变动
默克医药健康全球执行副总裁、中国及国际市场负责人周虹正式离任,其将加盟丹麦制药巨头诺和诺德,接任产品与组合战略执行副总裁一职
2026-02-05 11:58
 资讯
资讯 104亿元!2026年小核酸领域首笔出海BD诞生
圣因生物与罗氏集团旗下子公司基因泰克达成全球研发合作与许可协议,双方将基于圣因生物专有的RNAi药物研发平台,共同推进一款RNAi疗法的开发。
2026-02-05 11:50
 资讯
资讯 合成生物企业桦冠生物宣布完成数亿元C轮融资
本轮融资由软银欣创、顺禧基金、常州启航合成生物创投基金、国投创益、长江资本等多家知名机构联合投资,光源资本担任财务顾问,所融资金将重点投向医药与大健康领域新品研发、...
2026-02-04 11:50
 资讯
资讯 AI制药独角兽深度智耀完成6000万美元新一轮融资,加速全栈式研发解决方案落地
本轮融资吸引了信宸资本、金镒资本、凯泰资本等新投资方入局,老股东鼎晖百孚、新鼎资本持续追加投资
2026-02-03 20:03
 资讯
资讯 济川药业联合康方生物,共拓心血管创新药商业化新局
伊喜宁®(伊努西单抗注射液)是康方生物自主开发创新的PCSK9单克隆抗体新药,于2024年9月获批上市,用于治疗原发性高胆固醇血症和混合型高脂血症,包括杂合子家族性高胆固醇血...
2026-02-03 19:34
拜耳诺倍戈®第三项适应症在中国获批,用于治疗转移性激素敏感性前列腺癌(mHSPC)
诺倍戈®此前已先后获批用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者,和联合多西他赛治疗转移性激素敏感性前列腺癌的(mHSPC)成年患者。
2026-02-03 18:42